

Оставить заявку
Оставить заявку

ОСТАВИТЬ ЗАЯВКУ
Заполняя данную форму, вы соглашаетесь с Правилами обработки персональных данных
Импульсы аргоновой и азотной плазмы сокращают выделение кожного сала у лиц с жирным типом кожи, регулируя липогенез и пролиферацию себоцитов человека
20 Августа 2025
Новые технологии красоты


01
Аннотация
Несмотря на то, что уже разработано несколько электрических аппаратов, ориентированных на работу с сальными железами, по-прежнему необходим эффективный и безопасный терапевтический аппарат для работы с гиперсебореей. Нетермическая плазма при атмосферном давлении (НТПАД) вызывает микроскопические реакции в тканях сальных желез у лабораторных крыс.
Пятнадцать терапевтически здоровых волонтеров с жирным типом кожи лица прошли 3 процедуры с аргоновой и азотной НТПАД. Исследователями оценивался обычный уровень выделения кожного сала, интенсивность выделения кожного сала, индекс порфиринов и гистологический анализ. Импульсы аргоновой и азотной НТПАД были направлены на SZ95 себоциты, обработанные тестостероном и линолевой кислотой. Липиды прошли оценку с использованием BODIPY (9H7BF2N2) и квантитативного окрашивания Нильским красным. Оценивались маркеры пролиферации и дифференциации.
На 4 неделю импульсы аргоновой и азотной НТПАД сократили обычные уровни кожного сала и интенсивность выработки кожного сала. Индекс порфиринов выявил 38% сокращение на 2 неделе. Образцы кожи, отобранные для биопсии, не показали существенной термической коагуляции, но количество клеток Ki67+ в сальных железах сократилось на 2 неделе. Аргоновая и азотная НТПАД препятствуют увеличению синтеза липидов, клеток Ki67+ и агонист альфа-рецепторов, активируемых пролифераторами пероксисом, вызванных тестостероном и линолевой кислотой в себоцитах человека без апоптоза.
Терапия с аргоновой и азотной НТПАД – это безопасный и эффективный метод сокращения выработки кожного сала для людей с жирным типом кожи, который предотвращает липогенез и пролиферацию в себоцитах человека.
Пятнадцать терапевтически здоровых волонтеров с жирным типом кожи лица прошли 3 процедуры с аргоновой и азотной НТПАД. Исследователями оценивался обычный уровень выделения кожного сала, интенсивность выделения кожного сала, индекс порфиринов и гистологический анализ. Импульсы аргоновой и азотной НТПАД были направлены на SZ95 себоциты, обработанные тестостероном и линолевой кислотой. Липиды прошли оценку с использованием BODIPY (9H7BF2N2) и квантитативного окрашивания Нильским красным. Оценивались маркеры пролиферации и дифференциации.
На 4 неделю импульсы аргоновой и азотной НТПАД сократили обычные уровни кожного сала и интенсивность выработки кожного сала. Индекс порфиринов выявил 38% сокращение на 2 неделе. Образцы кожи, отобранные для биопсии, не показали существенной термической коагуляции, но количество клеток Ki67+ в сальных железах сократилось на 2 неделе. Аргоновая и азотная НТПАД препятствуют увеличению синтеза липидов, клеток Ki67+ и агонист альфа-рецепторов, активируемых пролифераторами пероксисом, вызванных тестостероном и линолевой кислотой в себоцитах человека без апоптоза.
Терапия с аргоновой и азотной НТПАД – это безопасный и эффективный метод сокращения выработки кожного сала для людей с жирным типом кожи, который предотвращает липогенез и пролиферацию в себоцитах человека.
02
Предпосылки
Плазма состоит из заряженных частиц ионов и электронов, нейтральных атомов, фотонов и радикалов, которые могут быть созданы искусственно поставкой энергии к инертному газообразному источнику. Плазма, созданная искусственным путем, подразделяется на термическую и нетермическую, в зависимости от температуры, и плазму низкого или атмосферного давления, в зависимости от давления газа. Из них нетермическая плазма атмосферного давления (НТПАД) используется в медицине для лечения различных состояний, среди которых раны в хроническом или остром состоянии, воспаления и инфекционные заболевания, без прямого термического повреждения живых тканей.
Несколько инертных газов могут использоваться для генерации НТПАД для медицинских целей, а именно атмосферный воздух, гелий, аргон и азот. Радиочастота ультравысокой частоты или микроволновая энергия обычно используются для генерации возбужденного ионизированного газа. Пилотное исследование гистологически исследовало аллергические реакции кожи крыс немедленного и замедленного типа после стимуляции аргоновой и азотной НТПАД.
В результатах сообщалось о различных реакциях тканей в зависимости от газообразного источника различных спектров испускания (аргон против азота) и настроек процедуры. Процедура с НТПАД приводит к микроскопическим реакциям в тканях фолликулярного эпителия и сальных желез. Интересно, что реакции ткани в виде вакуолизации в ответ на стимуляцию аргоновой НТПАД наблюдались в эпидермисе, растянувшемся вдоль фолликулярного эпителия к устью сальной железы.
Гистологические особенности термической модификации и коагуляции обозревались в себоцитах, но не в прилегающей стромальной ткани кожи крысы, претерпевшей импульс аргоновой НТПАД. Низкоэнергетические процедуры с азотной НТПАД также привели к термическим реакциям ткани в сальных железах, при этом прилегающая дермальная стромальная ткань не повреждалась. Принимая это во внимание, можно утверждать, что перенос высокоэнергетической азотной НТПАД приводит к обширной термической коагуляции в эпидермисе и в верхних до срединных слоев дермы.
Данные результаты объясняют воздействие НТПАД на физиологию сальных желез человека. Тем не менее, сопутствующих данных не хватает. Кожное сало необходимо для поддержания увлажненности рогового слоя эпидермиса, низкого уровня pH на поверхности кожи, поддержания антибактериального барьера кожи. Однако, излишняя выработка кожного сала может привести к развитию акне. Именно поэтому мы исследовали воздействие аргоновой и азотной НТПАД на выработку кожного сала, дифференциацию и пролиферацию клеток сальных желез в коже человека жирного типа в лабораторных условиях и в культивированных себоцитах человека.
Несколько инертных газов могут использоваться для генерации НТПАД для медицинских целей, а именно атмосферный воздух, гелий, аргон и азот. Радиочастота ультравысокой частоты или микроволновая энергия обычно используются для генерации возбужденного ионизированного газа. Пилотное исследование гистологически исследовало аллергические реакции кожи крыс немедленного и замедленного типа после стимуляции аргоновой и азотной НТПАД.
В результатах сообщалось о различных реакциях тканей в зависимости от газообразного источника различных спектров испускания (аргон против азота) и настроек процедуры. Процедура с НТПАД приводит к микроскопическим реакциям в тканях фолликулярного эпителия и сальных желез. Интересно, что реакции ткани в виде вакуолизации в ответ на стимуляцию аргоновой НТПАД наблюдались в эпидермисе, растянувшемся вдоль фолликулярного эпителия к устью сальной железы.
Гистологические особенности термической модификации и коагуляции обозревались в себоцитах, но не в прилегающей стромальной ткани кожи крысы, претерпевшей импульс аргоновой НТПАД. Низкоэнергетические процедуры с азотной НТПАД также привели к термическим реакциям ткани в сальных железах, при этом прилегающая дермальная стромальная ткань не повреждалась. Принимая это во внимание, можно утверждать, что перенос высокоэнергетической азотной НТПАД приводит к обширной термической коагуляции в эпидермисе и в верхних до срединных слоев дермы.
Данные результаты объясняют воздействие НТПАД на физиологию сальных желез человека. Тем не менее, сопутствующих данных не хватает. Кожное сало необходимо для поддержания увлажненности рогового слоя эпидермиса, низкого уровня pH на поверхности кожи, поддержания антибактериального барьера кожи. Однако, излишняя выработка кожного сала может привести к развитию акне. Именно поэтому мы исследовали воздействие аргоновой и азотной НТПАД на выработку кожного сала, дифференциацию и пролиферацию клеток сальных желез в коже человека жирного типа в лабораторных условиях и в культивированных себоцитах человека.
03
Изображение 1 Результаты применения нетермической аргоновой и азотной плазмы атмосферного давления при секреции себума среди испытуемых с жирным типом кожи лица. Обычная активность сальных желез (А) и интенсивность выделения секрета сальных желез (В) были вычислены с помощью себометра до начала процедуры, а также в дальнейшем на 2, 4 и 8 неделях исследования. Значения представлены ± со стандартной погрешностью среднего (SEM; n=15). Данные также были проанализированы согласно Т-критерию Уилкоксона (*P < 0.05, **P < 0.01, ***P < 0.001, при сравнении с данными до начала процедур).
Результаты
Таблица 1 Демографические характеристики испытуемых.
Супрессивный эффект от НТПАД на выработку кожного сала постепенно ослабился к 8 неделе (Изобр. 1а). Интенсивность выработки кожного сала на лбу, левой и правой щеке сократилась на 12.4%, 12.7% и 18.2%, соответственно, на 2 неделе; и на 26.6%, 22.7% и 23%, соответственно, на 4 неделе по сравнению с показателями до начала процедур, затем, подавляющее действие ослабило результаты к 8 неделе (Изобр. 1b). Многие испытуемые отметили временное покраснение, которое прошло в течение 24 часов. В течение последующих 8 недель не отмечалось каких-либо серьезных побочных эффектов, связанных с проведенной процедурой.
Прежде всего мы оценили воздействие аргоновой и азотной НТПАД на выделение кожного сала на испытуемых с жирной кожей лица. В данном этапе лабораторного исследования приняли участие пятнадцать терапевтически здоровых волонтеров в возрасте от 19 до 35 лет.
В таблице 1 указаны демографические характеристики и показатели до начала курса процедур. До первой процедуры среднее значение (+стандартное отклонение) уровней выработки кожного сала на лбу и обеих щеках составляло 238.2±58.18 и 191.7±51.66 мг/см2, соответственно.
Обычный уровень кожного сала на лбу и обеих щеках существенно снизился спустя 2 и 4 недели по сравнению с показателями до начала курса процедур. Максимальное снижение уровня кожного сала было отмечено на 4 неделе. Среднее значение было измерено на лбу, левой и правой щеках, и снижение составило 16.0%, 19.4% и 18.7%, соответственно, на второй неделе; и 28%, 24% и 22.3%, соответственно, - на 4 неделе.
В таблице 1 указаны демографические характеристики и показатели до начала курса процедур. До первой процедуры среднее значение (+стандартное отклонение) уровней выработки кожного сала на лбу и обеих щеках составляло 238.2±58.18 и 191.7±51.66 мг/см2, соответственно.
Обычный уровень кожного сала на лбу и обеих щеках существенно снизился спустя 2 и 4 недели по сравнению с показателями до начала курса процедур. Максимальное снижение уровня кожного сала было отмечено на 4 неделе. Среднее значение было измерено на лбу, левой и правой щеках, и снижение составило 16.0%, 19.4% и 18.7%, соответственно, на второй неделе; и 28%, 24% и 22.3%, соответственно, - на 4 неделе.
Импульсы аргоновой и азотной НТПАД сократили выделение кожного сала в человеческой коже жирного типа
Флуоресценция порфирина в зоне, пораженной себореей, снизилась после процедуры с аргоновой и азотной НТПАД
Бактерия Cutibacterium acnes (C. acnes) в основном находится зонах с большим количеством сальных желез. Чтобы оценить воздействие аргоновой и азотной НТПАД на скопление C.acnes в зонах, пораженных себореей, у семи испытуемых с жирным типом кожи порфириновые компоненты были проанализированы до начала исследования и на 2 неделю с использованием цифровых ультрафиолетовых снимков и анализатора. Красное свечение, вызванное ультрафиолетом в фолликулах сигнализирует о присутствии порфиринов, в том числе и копропорфирина III и протопорфирина IX, которые производятся анаэробными грамотрицательными бактериями, такими как C.acnes. Средний индекс порфирина на второй неделе снизился на лбу и на обеих щеках на 27.7% и 37.7%, соответственно, в сравнении с показателями до начала исследованиями (Изобр.2).
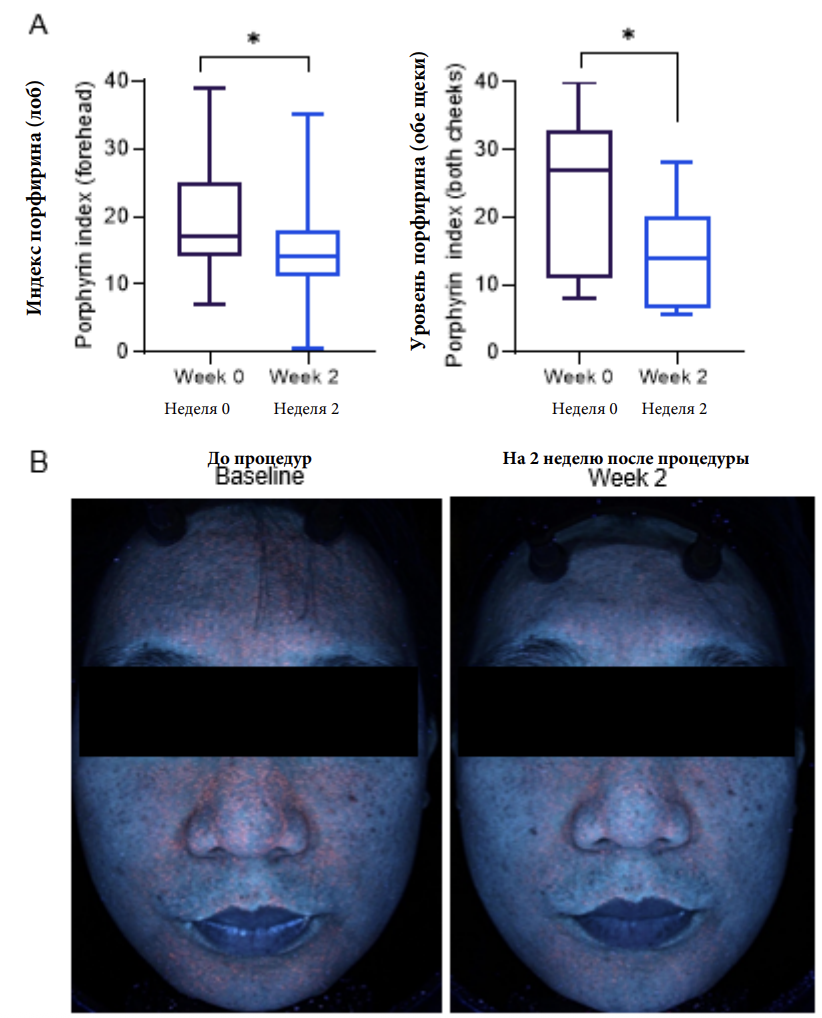
Изображение 2 Импульсы нетермической аргоновой и азотной плазм атмосферного давления сократили порфирины, вырабатываемые C. acnes в себорейных участках у испытуемых с жирной кожи лица. (А) показатель порфирина, который был определен с помощью анализатора цифровых фотографий для ультрафиолетовых снимков. Снимки были сделаны до процедур и спустя 2 недели применения импульсов нетермической аргоновой и азотной плазм атмосферного давления. Значения представлены ± со стандартной погрешностью среднего (n=7). Данные также были проанализированы согласно Т-критерию Уилкоксона (*P < 0.05 при сравнении с начальным уровнем). (В) Представлены снимки в ультрафиолетовом диапазоне, они сделаны до начала процедур и на 2 неделе.
Импульсы аргоновой и азотной НТПАД сократили маркер пролиферации Ki67 в базальных клетках сальных желез и клетках эпителия выводных протоков у лиц с жирным типом кожи
Для того, чтобы рассмотреть воздействие НТПАД на гистологические изменения сальных желез кожи человека, мы провели биопсию кожи, взятой со скуловой области двух испытуемых до проведения процедур и на вторую неделю. Биопсии, выполненные через 2 недели после процедуры, не показали очевидной коагуляции в сальных железах и окружающей их дерме. Несмотря на то, что окрашивание гемотоксилином и эозином не выявило очевидных различий в количестве или размере сальных желез, иммуногистохимическое исследование показало, что количестве клеток Ki67 в базальном слое сальных желез и эпителии выводных протоков сальных желез значительно сократилось на 2 неделе по сравнению с показателями до начала процедуры (Изобр. 3).
Не отмечалось значительных изменений в себоцитах, окрашенных ядерным агонистом альфа-рецепторов, активируемых пролифераторами пероксисом (PPARγ), замеренных до начала процедуры и на 2 неделю (данные не отображены). Неравновесная плазма атмосферного давления и плазмоактивированная среда продемонстрировали стимуляцию межклеточной аккумуляции активных форм кислорода (АФК) 15; Следовательно, мы также оценили биомаркер оксидативного стресса, 4-гидроксиноненал (4-HNE) и не обнаружили существенных изменений в его иммунореактивности (до процедуры и спустя 2 недели) (данные не отображены).
Не отмечалось значительных изменений в себоцитах, окрашенных ядерным агонистом альфа-рецепторов, активируемых пролифераторами пероксисом (PPARγ), замеренных до начала процедуры и на 2 неделю (данные не отображены). Неравновесная плазма атмосферного давления и плазмоактивированная среда продемонстрировали стимуляцию межклеточной аккумуляции активных форм кислорода (АФК) 15; Следовательно, мы также оценили биомаркер оксидативного стресса, 4-гидроксиноненал (4-HNE) и не обнаружили существенных изменений в его иммунореактивности (до процедуры и спустя 2 недели) (данные не отображены).
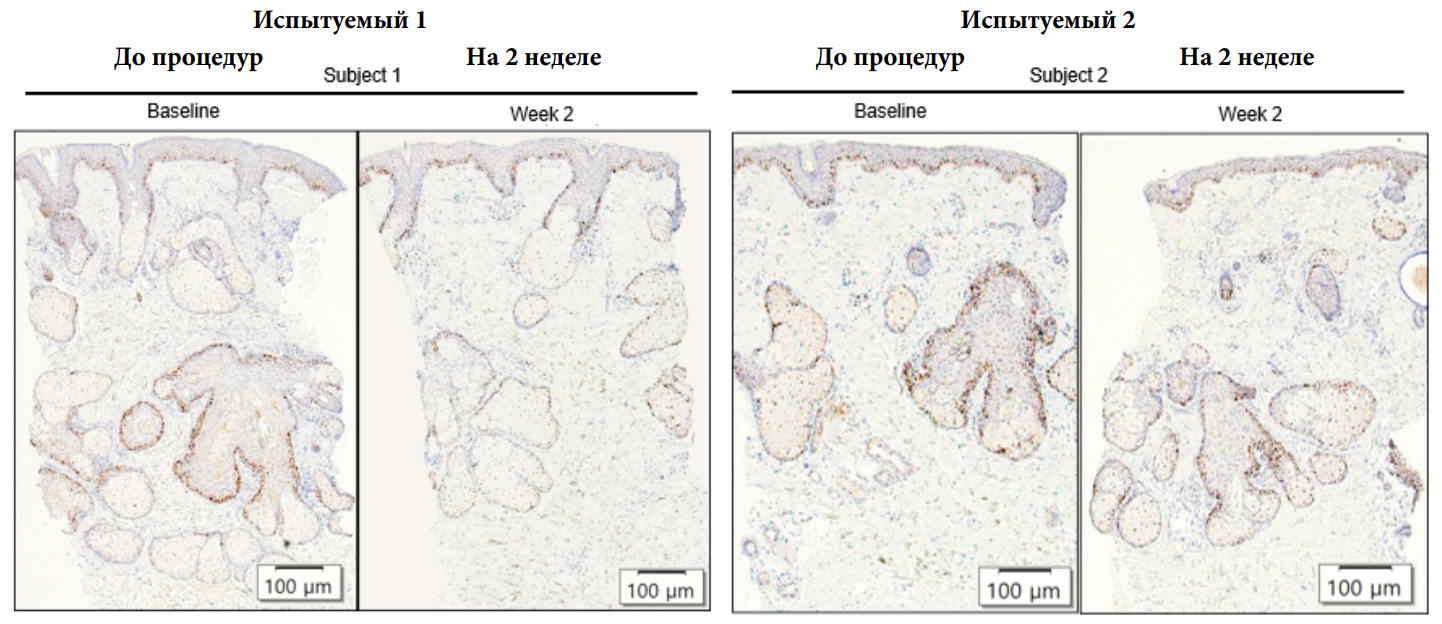
Изображение 3 На изображении представлено иммуногистохимическое исследование экспрессии Ki-67, проведенное на лице человека до процедур и спустя 2 недели после курса процедур с плазмой. Положительно иммуноокрашенные клетки выделены коричневым цветом, клеточные ядра - голубым. Масштабная метка: 100 мкм.
Импульсы аргоновой и азотной НТПАД снизили выработку липидов в культурированных себоцитах человека SZ95
Для того, чтобы изучить механизмы, участвующие в супрессивном воздействии на секрецию кожного сала импульсов аргоновой и азотной НТПАД на жирную кожу в лабораторных условиях, мы оценили воздействие импульсов НТПАД на липогенез человеческих себоцитов SZ95, которые имеют те же основные характеристики, что и обычные себоциты. Прежде всего мы оценили цитотоксичность импульсов аргоновой и азотной НТПАД в себоцитах, используя МТТ-тест.
В течение 48 часов 20 из 60 импульсов аргоновой НТПАД при 0.75 Дж и 5 из 10 импульсов азотной НТПАД при 1.5 Дж не вызвали зарегистрированных изменений в жизнеспособности себоцитов (Изобр. 4а), именно поэтому данные экспериментальные настройки были использованы в последующих экспериментах. Чтобы исследовать воздействие НТПАД на липогенез, стимулированный агентами, ассоциирующимися с акне, мы направили импульсы аргоновой и азотной НТПАД на себоциты SZ95 сразу же или спустя 24 часа после проведения процедуры с комбинацией тестостерона и линолевой кислоты.
В течение 48 часов 20 из 60 импульсов аргоновой НТПАД при 0.75 Дж и 5 из 10 импульсов азотной НТПАД при 1.5 Дж не вызвали зарегистрированных изменений в жизнеспособности себоцитов (Изобр. 4а), именно поэтому данные экспериментальные настройки были использованы в последующих экспериментах. Чтобы исследовать воздействие НТПАД на липогенез, стимулированный агентами, ассоциирующимися с акне, мы направили импульсы аргоновой и азотной НТПАД на себоциты SZ95 сразу же или спустя 24 часа после проведения процедуры с комбинацией тестостерона и линолевой кислоты.
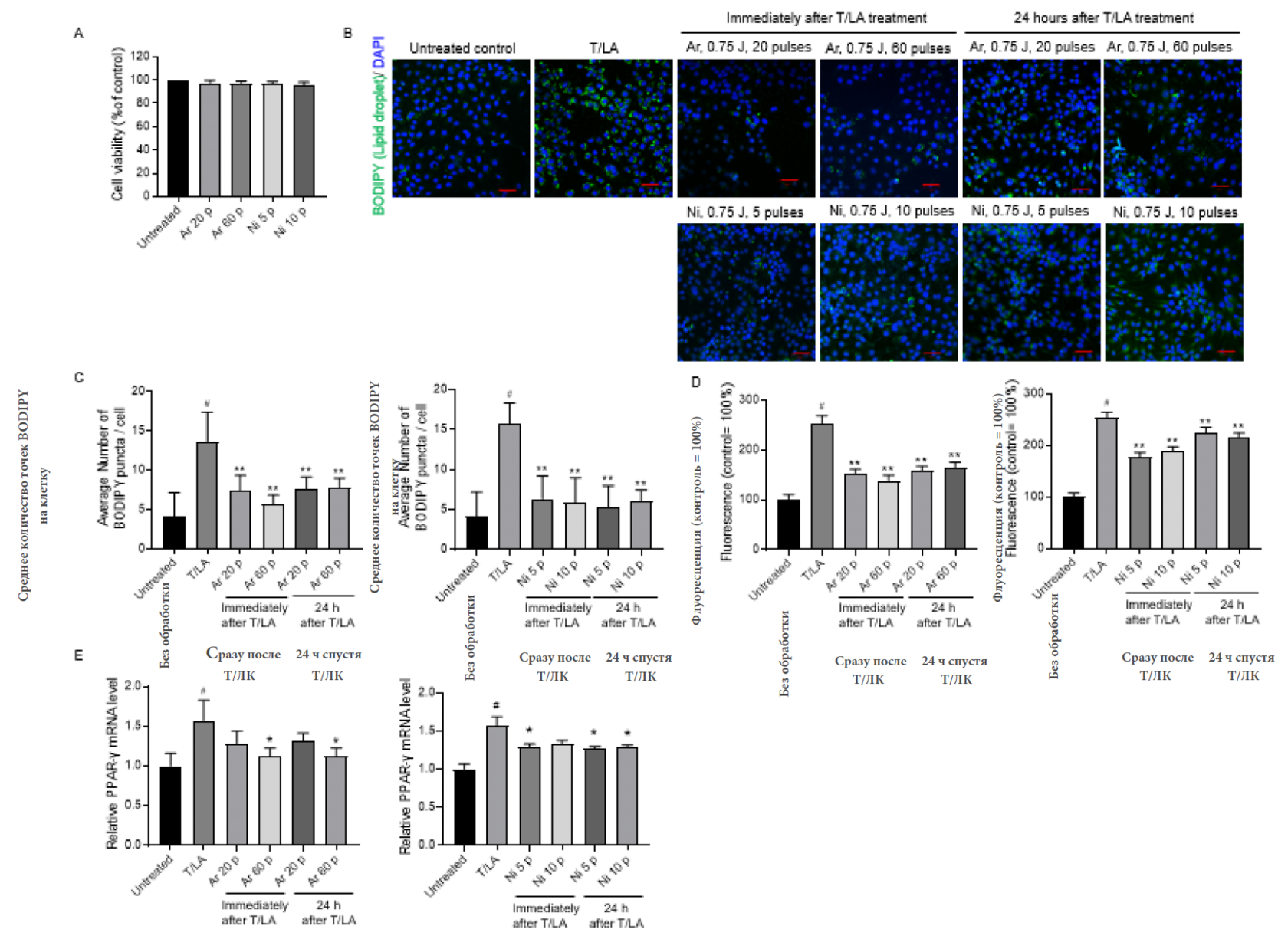
Изображение 4 Влияние импульсов аргоновой и азотной НТПАД на жизнеспособность и липидный синтез себоцитов человека. (А) Себоциты SZ95 подверглись импульсам аргоновой и азотной НТПАД на протяжение 48 часов, затем проводился МТТ-тест. Значения представлены ± со стандартной погрешностью среднего (n=3). (В) Конфокальные иммунофлуоресцентные изображения BODIPY-соединений в себоцитах человека SZ95, обработанных Т/ЛК в течение 48 часов или в сочетании с импульсами аргоновой и азотной НТПАД сразу или через 24 часа после обработки T/ЛК. Масштабная метка: 50 мкм. (С) Среднее количество BODIPY положительных точек в себоцитах человека представлено на диаграмме. Данные представлены ± со стандартной погрешностью среднего. (n=25) (D) Нейтральные липиды были определены количественно путем окрашивания Нильским красным, затем измерения проводились при помощи сканера рентгенографических пластин. Данные представлены ± со стандартной погрешностью среднего. (Е) Количественное определение PPARγ и иРНК путем ПЦР-анализа. Результаты нормализованы по внутреннему контрольному образцу ГАФДГ (Глицеральдегид-3-фосфатдегидрогеназы), и представлены в сравнении с контрольными клетками, инкубированными в культурной среде. Значения представлены ± со стандартной погрешностью среднего трех исследований. #P<0,05 сравнение с необработанным материалом и *P<0,05, **P<0,01 по сравнению с клетками, обработанными тестостероном/линолевой кислотой с помощью непарного двухстороннего t-критерия Стьюдента. T/ЛК, тестостерон/линолевая кислота; Ar, аргон; Ni, азот; р - импульсы.
Затем содержание межклеточных нейтральных липидов было оценено с помощью BODIPY с количественным окрашиванием Нильским красным. 20 или 60 импульсов аргоновой НТПАД при 0.75 Дж сразу же или спустя 24 часов после процедуры с тестостероном и линолевой кислотой значительно снизили аккумуляцию липидов под влиянием Т/ЛК в себоцитах, как показало количественное окрашивание Нильским красным (Изобр. 4d). В дальнейшем 5 или 10 импульсов азотной НТПАД при 1.5 Дж также подавили синтез нейтральных липидов под воздействием Т/ЛК в себоцитах при воздействии сразу после процедуры или 24 часа спустя обработки Т/ЛК (Изоб. 4б-г).
Чтобы пролить свет на молекулярный механизм того, как импульсы аргоновой или азотной НТПАД подавляют синтез липидов кожного сала, мы исследовали воздействие импульсов аргоновой и азотной НТПАД на экспрессию агониста альфа-рецепторов, активируемых пролифераторами пероксисом, т. е. потенциального модулятора дифференциации себоцитов и синтеза липидов. Экспрессия гена PPARγ увеличилась после взаимодействия с Т/ЛК в течение 48 часов и сопутствующей обработки аргоновой НТПАД (0.75 Дж, 60 импульсов) или азотной НТПАД (1.5 Дж, 10 импульсов) и подавила повышенную регуляцию иРНК PPARγ, стимулированного Т/ЛК (Изоб. 4д). Данные результаты четко показывают, что аргоновая и азотная НТПАД подавляют липогенез, стимулированный андрогеном и PPAR стимулятором, в себоцитах и также намекают на то, что ингибитор стимуляции PPARγ может частично влиять на подавляющий эффект НТПАД на секрецию кожного сала.
Чтобы пролить свет на молекулярный механизм того, как импульсы аргоновой или азотной НТПАД подавляют синтез липидов кожного сала, мы исследовали воздействие импульсов аргоновой и азотной НТПАД на экспрессию агониста альфа-рецепторов, активируемых пролифераторами пероксисом, т. е. потенциального модулятора дифференциации себоцитов и синтеза липидов. Экспрессия гена PPARγ увеличилась после взаимодействия с Т/ЛК в течение 48 часов и сопутствующей обработки аргоновой НТПАД (0.75 Дж, 60 импульсов) или азотной НТПАД (1.5 Дж, 10 импульсов) и подавила повышенную регуляцию иРНК PPARγ, стимулированного Т/ЛК (Изоб. 4д). Данные результаты четко показывают, что аргоновая и азотная НТПАД подавляют липогенез, стимулированный андрогеном и PPAR стимулятором, в себоцитах и также намекают на то, что ингибитор стимуляции PPARγ может частично влиять на подавляющий эффект НТПАД на секрецию кожного сала.
В лабораторных условиях импульсы аргоновой и азотной НТПАД препятствуют пролиферации себоцитов SZ95
Чтобы подкрепить полученные результаты сокращения маркера пролиферации Ki67 в сальных железах жирной кожи после процедур с аргоновой и азотной НТПАД в живом организме, мы проверили эффект от НТПАД на пролиферации культурированных SZ95 себоцитов в лабораторных условиях, замерив клетки Ki-67+. Как констатировалось ранее, Т/ЛК усиливали пролиферацию себоцитов SZ95. 20 или 60 импульсов аргоновой НТПАД при 0.75 Дж, или 5 или 10 импульсов азотной НТПАД при 1.5 Дж значительно подавляли увеличение клеток Ki-67+ , стимулированные Т/ЛК при немедленной процедуре или спустя 24 часа после процедуры обработки с Т/ЛК (Изобр.5а и b). Наши данные говорят о том, что импульсы аргоновой и азотной НТПАД предотвращают пролиферацию себоцитов человека без стимуляции апоптоза.
04
Обсуждение
В настоящем исследовании мы продемонстрировали, что по результатам трех процедур с импульсами аргоновой и азотной НТПАД, проведенных последовательно в течение трех недель, секреция кожного сала в жирной коже лица сократилась с максимальной эффективностью на 4 неделе у большинства испытуемых, что было отмечено наряду с сокращением количества пролиферирующих клеток Ki-67 в сальных железах. Насколько нам известно, результаты данного исследования являются первыми, в которых отображается воздействие импульсов НТПАД на сальные железы живого человека. Предыдущее исследование с лабораторной крысой отмечало, что аргоновая плазма привела к микроскопическим изменениям в сальных железах и связанном с ними фолликулярном эпителии без излишнего термического повреждения, и азотная плазма вызвала энергетически зависимую термическую коагуляцию в пилосебацейных комплексах.
В противовес предыдущим результатам исследования на грызунах, гистологический анализ человеческой кожи, претерпевшей процедуру с импульсами аргоновой и азотной НТПАД, не показал явных изменений, связанных с термическим повреждением интерфолликулярного эпидермиса и сальных желез в этом исследовании. Это несоответствие может быть связано с отличиями в настройках подаваемой энергии. В исследовании с крысами импульсы аргоновой и азотной НТПАД подавались при 0.8 Дж/импульс и 3 Дж/импульс, соответственно. Человеческая же кожа прошла процедуры при более низких значениях энергии: аргоновая НТПАД при 0.8 Дж/импульс и азотная при 0.75 Дж/импульс, с целью сделать процедуру более безопасной.
В противовес предыдущим результатам исследования на грызунах, гистологический анализ человеческой кожи, претерпевшей процедуру с импульсами аргоновой и азотной НТПАД, не показал явных изменений, связанных с термическим повреждением интерфолликулярного эпидермиса и сальных желез в этом исследовании. Это несоответствие может быть связано с отличиями в настройках подаваемой энергии. В исследовании с крысами импульсы аргоновой и азотной НТПАД подавались при 0.8 Дж/импульс и 3 Дж/импульс, соответственно. Человеческая же кожа прошла процедуры при более низких значениях энергии: аргоновая НТПАД при 0.8 Дж/импульс и азотная при 0.75 Дж/импульс, с целью сделать процедуру более безопасной.
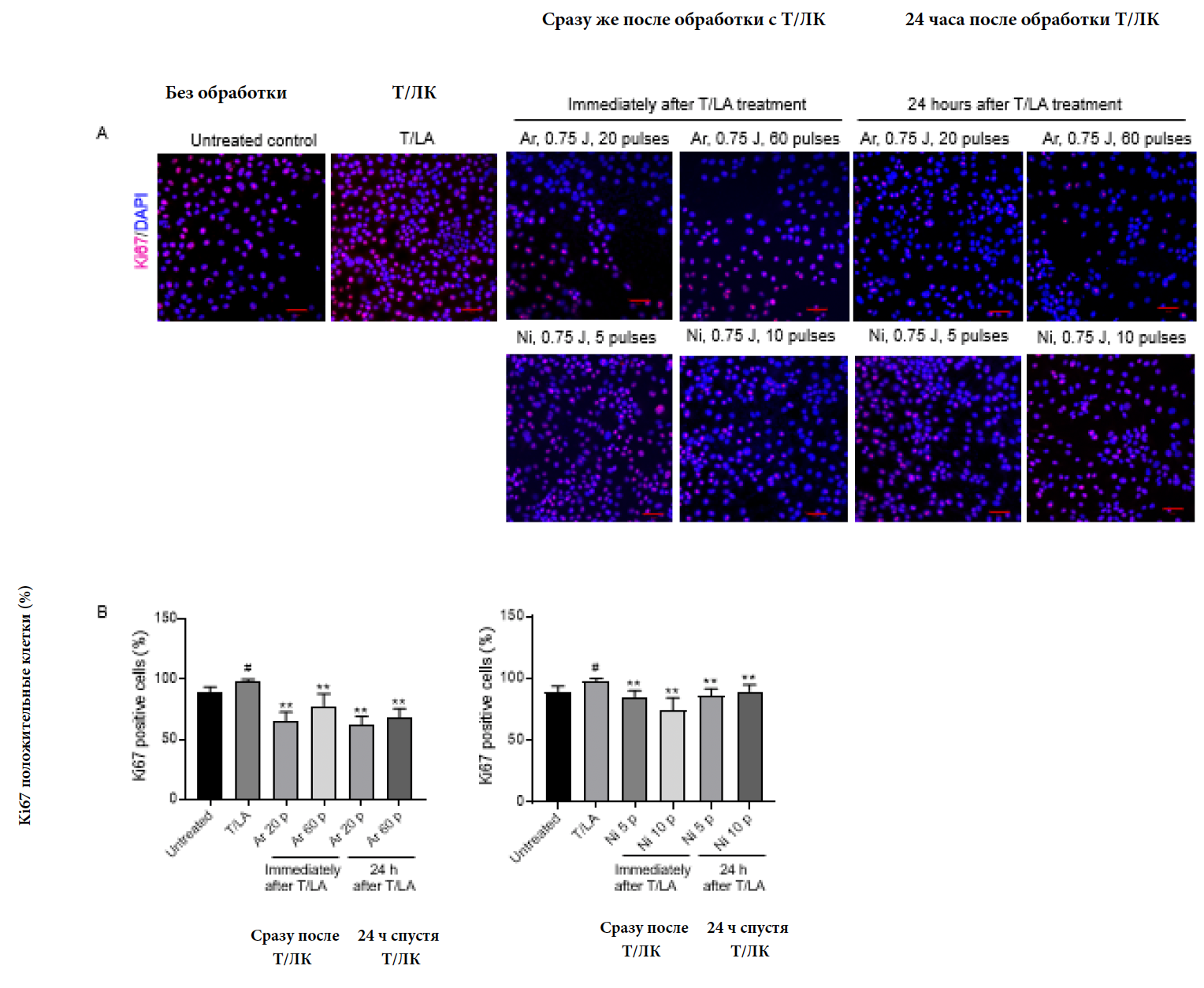
Изображение 5 Аргоновая и азотная НТПАД могут регулировать пролиферацию культивированных себоцитов SZ95. (А) Иммунофлюоресценция себоцитов SZ95 обработанных только T/ЛК, на протяжении 48 часов или в сочетании с импульсами аргоновой и азотной НТПАД, окрашенные для иммуногистохомического исследования экспрессии Ki67. Масштабная метка: 50 мкм. (В) Процентное соотношение ядросодержащих положительных клеток Ki67 к общему количеству окрашенных ДАФИ (DAPI) положительных клеток в клетках SZ95, обработанных тестостероном/линолевой кислотой, с или без импульсов аргоновой и азотной плазмы НТПАД. Значения представлены ± со стандартной погрешностью среднего. P<0,05 по сравнению с контрольный необработанным материалом и *P<0,05, **P<0,01 по сравнению с клетками, обработанными тестостероном/линолевой кислотой с помощью непарного двухстороннего t-критерия Стьюдента. T/ЛК, тестостерон/линолевая кислота; Ar, аргон; Ni, азот; р - импульсы.
Кроме того, воздействие НТПАД при тех же значениях энергии может быть завышено у крыс, так как кожа человека менее проницаема по сравнению с кожей крысы. Более того, изменения в тканях крысиной кожи прошли оценку блоками на 1, 5 и 7 дни после процедуры с применением плазмы, а кожа человека была осмотрена спустя 2 недели после процедуры. Поэтому не стоит исключать возможность ранних переходных реакций тканей. Дополнительные исследования гистологических изменений в коже человека в динамике после процедур с импульсами НТПАД при различных настройках энергии потребуются для того, чтобы осуществить безопасное внедрение данной технологии в клиниках. В целом, результаты наших исследований показали, что импульсы аргоновой и азотной НТПАД подавляют секрецию кожного сала в жирной коже человека, что скорее всего связано с предотвращением пролиферации клеток сальных желез и протоков, а не с термическим повреждением сальных желез.
В зависимости от дозы, НТПАД продемонстрировала возможность стимуляции или предотвращения пролиферации многих типов клеток. Биологическое воздействие плазмы, скорее всего, связано с генерацией активных форм кислорода (АФК). Высокие уровни АФК способны вызвать оксидативный стресс, остановку клеточного цикла и повреждение ДНК. В настоящем исследовании процедура с НТПАД на жирной коже человека не стимулировала отслеживаемых изменений в экспрессии 4-HNE, маркера оксидативного стресса в обрабатываемых железах.
Эти результаты предполагают, что предотвращение пролиферации клеток в сальных железах посредством импульсов НТПАД при параметрах, использованных в данном исследовании, не зависят, в первую очередь, от излишней выработки АФК. Чтобы более детально изучить молекулярные механизмы, стоящие за суппресивным воздействием на выработку кожного сала и запущенные импульсами аргоновой и азотной НТПАД в коже живого человека, мы рассмотрели воздействия импульсов НТПАД на функционирование человеческих себоцитов, включая липогенез, пролиферацию и дифференциацию. Импульсы аргоновой и азотной НТПАД предотвращали синтез нейтральных липидов, стимулированный Т/ЛК, в себоцитах человека при обработке в недифференцированном состоянии или дифференцированном и состоянии, ранее простимулированном Т/ЛК. Это предполагает, что импульсы аргоновой и азотной НТПАД могут препятствовать излишней выработке липидов, стимулированных теми же процессами, которые запускают процесс акне, такими как тестостерон и линолевая кислота.
Недавно полученные доказательства свидетельствуют, что НТПАД регулирует пролиферацию и дифференциацию клеток во многих типах клеток. Дифференциация себоцитов регулируется сложной системой транскрипционных факторов, в которых PPARγ играет важную роль в созревании себоцитов, стимулируя синтез липидов сальных желез. Мы выявили, что обработка себоцитов SZ95 импульсами аргоновой и азотной НТПАД во время первых 24 часов с момента дифференциации, стимулированной Т/ЛК, предотвращала стимуляцию экспрессии гена PPARγ в течение 48 часов после процедуры с Т/ЛК. Эти данные обозначают, что импульсы аргоновой и азотной плазмы могут снизить липогенез, стимулированный дифференциацией в себоцитах человека, посредством подавления сигналов PPARγ.
Эти результаты предполагают, что предотвращение пролиферации клеток в сальных железах посредством импульсов НТПАД при параметрах, использованных в данном исследовании, не зависят, в первую очередь, от излишней выработки АФК. Чтобы более детально изучить молекулярные механизмы, стоящие за суппресивным воздействием на выработку кожного сала и запущенные импульсами аргоновой и азотной НТПАД в коже живого человека, мы рассмотрели воздействия импульсов НТПАД на функционирование человеческих себоцитов, включая липогенез, пролиферацию и дифференциацию. Импульсы аргоновой и азотной НТПАД предотвращали синтез нейтральных липидов, стимулированный Т/ЛК, в себоцитах человека при обработке в недифференцированном состоянии или дифференцированном и состоянии, ранее простимулированном Т/ЛК. Это предполагает, что импульсы аргоновой и азотной НТПАД могут препятствовать излишней выработке липидов, стимулированных теми же процессами, которые запускают процесс акне, такими как тестостерон и линолевая кислота.
Недавно полученные доказательства свидетельствуют, что НТПАД регулирует пролиферацию и дифференциацию клеток во многих типах клеток. Дифференциация себоцитов регулируется сложной системой транскрипционных факторов, в которых PPARγ играет важную роль в созревании себоцитов, стимулируя синтез липидов сальных желез. Мы выявили, что обработка себоцитов SZ95 импульсами аргоновой и азотной НТПАД во время первых 24 часов с момента дифференциации, стимулированной Т/ЛК, предотвращала стимуляцию экспрессии гена PPARγ в течение 48 часов после процедуры с Т/ЛК. Эти данные обозначают, что импульсы аргоновой и азотной плазмы могут снизить липогенез, стимулированный дифференциацией в себоцитах человека, посредством подавления сигналов PPARγ.
Систематически и местно увеличенный андроген приводит к увеличению пролиферации себоцитов у пациентов с акне. Мы выявили, что при таких настройках энергии, которые не стимулируют апоптоз клеток, импульсы и аргоновой, и азотной НТПАД существенно снизили пролиферирующие клетки Ki67 в себоцитах, обработанных Т/ЛК, что соответствует гистологическим изменениям в сальных железах человеческой кожи, обработанной НТПАД. Таким образом, результаты антипролифирирующего воздействия НТПАД в себоцитах человека как в живом испытуемым, так и в лаборатории могут сказаться на сокращении секреции кожного сала.
Следует отметить, что процедура с аргоновой и азотной НТПАД значительно сокращает уровни порфирина в коже жирного типа. Исходя из того, что порфирины производятся условно патогенными липофильными бактериями C.acnes, данные результаты исследования предполагают супресивное воздействие НТПАД на C.acnes. Недавние исследования показали антимикробное воздействие аргоновой плазмы в биологической среде и на искусственных поверхностях. Охлажденная аргоновая плазма атмосферного давления может обезвредить или убить микроорганизмы, напрямую вступая во взаимодействие с мембранами микробной клетки или повреждая клеточные мембраны, белки и ДНК заряженными или активными частицами. Недавнее рандомизированное контролируемое исследование показало существенное снижение бактериальной нагрузки в хронически инфицированных ранах после 5 минутной процедуры с охлажденной аргоновой плазмой атмосферного давления в живом человеке. Дополнительные исследования требуются, чтобы определить, сокращает ли аргоновая или азотная НТПАД колонии бактерий C.acnes, косвенно в результате сокращения кожного сала или напрямую убивая С.acnes.
В настоящее время пероральный прием изотретиноина считается наиболее эффективным способом борьбы с гиперсебореей. Тем не менее, его применение ограничено риском развития тератогенности, нарушения функции печени и возможными психологическими расстройствами. Наши результаты дают нам возможность предположить, что импульсы аргоновой и азотной НТПАД препятствуют выработке липидов, пролиферации клеток сальных желез и протоков, и транскрипции PPARγ в сальных железах, чтобы предотвратить гиперсеборею. Кроме того, клинические исследования в рамках данного проекта указывают на то, что терапия НТПАД оказывает себо-супрессивное воздействие, не вызывая очевидные термические повреждения кожи. С такими результатами процедура с аргоновой и азотной НТПАД может быть возможной альтернативной терапией, основанной на энергетических импульсах, таргетирующих сальные железы, не приводя к термическому повреждению тканей. Увеличенная выработка себума и пролиферация C.acnes в пило-себацейных комплексах важны для патогенеза акне. Принимая во внимание воздействие от аргоновой и азотной НТПАД на секрецию кожного сала и уровни порфиринов в жирной коже человека, они потенциально могут использоваться для лечения угрей. Необходимо провести дополнительные клинические исследования, чтобы убедиться в безопасности эффективности различных настроек подачи импульсов аргоновой и азотной НТПАД для проведения процедур для клиентов с угрями обыкновенными и гиперсебореей.
В настоящее время пероральный прием изотретиноина считается наиболее эффективным способом борьбы с гиперсебореей. Тем не менее, его применение ограничено риском развития тератогенности, нарушения функции печени и возможными психологическими расстройствами. Наши результаты дают нам возможность предположить, что импульсы аргоновой и азотной НТПАД препятствуют выработке липидов, пролиферации клеток сальных желез и протоков, и транскрипции PPARγ в сальных железах, чтобы предотвратить гиперсеборею. Кроме того, клинические исследования в рамках данного проекта указывают на то, что терапия НТПАД оказывает себо-супрессивное воздействие, не вызывая очевидные термические повреждения кожи. С такими результатами процедура с аргоновой и азотной НТПАД может быть возможной альтернативной терапией, основанной на энергетических импульсах, таргетирующих сальные железы, не приводя к термическому повреждению тканей. Увеличенная выработка себума и пролиферация C.acnes в пило-себацейных комплексах важны для патогенеза акне. Принимая во внимание воздействие от аргоновой и азотной НТПАД на секрецию кожного сала и уровни порфиринов в жирной коже человека, они потенциально могут использоваться для лечения угрей. Необходимо провести дополнительные клинические исследования, чтобы убедиться в безопасности эффективности различных настроек подачи импульсов аргоновой и азотной НТПАД для проведения процедур для клиентов с угрями обыкновенными и гиперсебореей.
Испытуемые
Пятнадцать терапевтически здоровых волонтеров в возрасте 19-35 лет приняли участие в лабораторном исследовании. Данное исследование было одобрено институциональным наблюдательным советом Университетского медицинского колледжа Ёнсе (ИНС № 3-2019-0239). Все методы были применены в соответствии с Хельсинской декларацией и Правилами проведения качественных клинических исследований, как предписано Корейским управлением по санитарному надзору за качеством пищевых продуктов и медикаментов и руководством Международной конференции по гармонизации технических требований к регистрации лекарственных средств для человека.
Демографические особенности и данные, зарегистрированные до первой процедуры, приведены в Таблице 1. Письменное информированное согласие было получено от всех участников до их включения в группу испытуемых. (ClinicalTrials.gov идентификатор: NCT04917835, 08/06/2021). До включения в группу испытуемых были замерены обычные уровни кожного сала на поверхности лба, правой и левой щек с помощью Себометра (Sebumeter) SM815; ООО «Кариж+Хазака Электроник ГмбХ» (Courage + Khazaka Electronic GmbH), г. Кёльн, Германия).
Кожа испытуемых была классифицирована на основании замеров уровней кожного сала, в соответствии с руководством аппарата: > 220 мкг/см2 на лбу и > 180 мкг/см2 на щеках – жирный тип кожи; 100–220 мкг/см2 на лбу и 70–180 мкг/см2 на щеках – нормальный тип кожи; < 100 мкг/см2 на лбу < 70 мкг/см2 на щеках – сухой тип кожи. Только участники с жирной кожей приняли участие в исследовании. До начала исследования среднее значение (± стандартная девиация) обычных уровней себума на лбу и обеих щеках было 38.2 ± 58.18 и 191.7 ± 51.66 мг/см2, соответственно. У всех испытуемых был III фототип по Фитцпарику и средняя степень тяжести угрей (1-2 балла по Корейской системе оценки тяжести акне).
Волонтеры были исключены из исследования, если в их анамнезе были хирургические или косметические процедуры, если они принимали системные ретиноиды в предшествующие 6 месяцев, наносили ретиноиды наружно в предшествующие 4 месяца, имели балл акне 3 и выше, имели сопутствующие системные заболевания, когда-либо страдали от гипертрофированных или келоидных шрамов, или были беременны.
Чтобы избежать суточных колебаний, уровни себума были измерены между 10:00 и 12:00. Испытуемых проинструктировали, что им нельзя было наносить косметику за 2 часа до замеров. Все замеры были выполнены одним и тем же врачом, прошедшим специальное обучение, в одной и той же комнате при температуре 220 °С и влажностью воздуха в 20-40% после 30 минутной акклиматизации.
Демографические особенности и данные, зарегистрированные до первой процедуры, приведены в Таблице 1. Письменное информированное согласие было получено от всех участников до их включения в группу испытуемых. (ClinicalTrials.gov идентификатор: NCT04917835, 08/06/2021). До включения в группу испытуемых были замерены обычные уровни кожного сала на поверхности лба, правой и левой щек с помощью Себометра (Sebumeter) SM815; ООО «Кариж+Хазака Электроник ГмбХ» (Courage + Khazaka Electronic GmbH), г. Кёльн, Германия).
Кожа испытуемых была классифицирована на основании замеров уровней кожного сала, в соответствии с руководством аппарата: > 220 мкг/см2 на лбу и > 180 мкг/см2 на щеках – жирный тип кожи; 100–220 мкг/см2 на лбу и 70–180 мкг/см2 на щеках – нормальный тип кожи; < 100 мкг/см2 на лбу < 70 мкг/см2 на щеках – сухой тип кожи. Только участники с жирной кожей приняли участие в исследовании. До начала исследования среднее значение (± стандартная девиация) обычных уровней себума на лбу и обеих щеках было 38.2 ± 58.18 и 191.7 ± 51.66 мг/см2, соответственно. У всех испытуемых был III фототип по Фитцпарику и средняя степень тяжести угрей (1-2 балла по Корейской системе оценки тяжести акне).
Волонтеры были исключены из исследования, если в их анамнезе были хирургические или косметические процедуры, если они принимали системные ретиноиды в предшествующие 6 месяцев, наносили ретиноиды наружно в предшествующие 4 месяца, имели балл акне 3 и выше, имели сопутствующие системные заболевания, когда-либо страдали от гипертрофированных или келоидных шрамов, или были беременны.
Чтобы избежать суточных колебаний, уровни себума были измерены между 10:00 и 12:00. Испытуемых проинструктировали, что им нельзя было наносить косметику за 2 часа до замеров. Все замеры были выполнены одним и тем же врачом, прошедшим специальное обучение, в одной и той же комнате при температуре 220 °С и влажностью воздуха в 20-40% после 30 минутной акклиматизации.
Генерация импульсов аргоновой и азотной НТПАД и использование их в медицине
Генератор НТПАД (PlaDuoTM, «Корпорация Шенб Лтд. (Shenb Co. Ltd.), г. Сеул, Южная Корея) использовался нами для генерации импульсов аргоновой и азотной НТПАД из инертных газообразных источников. Каждый источник невозбужденного газа заряжался на дальнем конце манипулы, затем, 2.45 ГГц микроволновой энергии конвертировали заряженный газ в плазму в сопле манипулы. Настройки процедуры, а именно объем загрузки и длительность импульса, были определены параметрами энергии; загрузочный объем 0.12-0.67 мл/импульс и длительность импульса в 4-18 мс при 0.12-0.75 Дж/импульс для газообразного аргона и 0.2-1.42 мл/импульс и 5-36 мс при 0.5-4 Дж/импульс - для азота. Как было одобрено комитетом по этике, испытуемые прошли три процедуры с интервалом между процедурами в одну неделю.
Два прохождения аргоновой НТПАД и два прохождения азотной НТПАД были последовательно выполнены в рамках каждой из процедур. Лоб, нос и обе щеки прошли обработку двумя прохождения импульсов аргоновой и азотной НТПАД при энергии импульса в 0.8 Дж/импульс с длительностью импульса в 12 мс и энергией импульса 0.75 Дж/импульс с длительностью импульса в 7 мс, соответственно. Обезболивающий крем для наружного применения при этом не использовался.
Диаметр сопла был 5 мм, расстояние между соплом и кожей составляло 10 мм. Обработанные зоны были охлаждены пакетами со льдом сразу же после процедуры. Все испытуемые прошли осмотры через 2, 4 и 8 недель после последней процедуры с НТПАД. Для того, чтобы исследовать побочные эффекты от процедур с плазмой, терапевтом оценивались симптомы испытуемых. Масштаб покраснения, отека, болевых ощущений, кровоточивости, шелушений, поствоспалительной гиперпигментации и появление шрамов оценивались в рамках каждого осмотра, используя аналоговую таблицу с баллами от 0 до 3 (0: отсутствие побочных эффектов, 1: умеренные, 2: средние, 3: серьезные).
Два прохождения аргоновой НТПАД и два прохождения азотной НТПАД были последовательно выполнены в рамках каждой из процедур. Лоб, нос и обе щеки прошли обработку двумя прохождения импульсов аргоновой и азотной НТПАД при энергии импульса в 0.8 Дж/импульс с длительностью импульса в 12 мс и энергией импульса 0.75 Дж/импульс с длительностью импульса в 7 мс, соответственно. Обезболивающий крем для наружного применения при этом не использовался.
Диаметр сопла был 5 мм, расстояние между соплом и кожей составляло 10 мм. Обработанные зоны были охлаждены пакетами со льдом сразу же после процедуры. Все испытуемые прошли осмотры через 2, 4 и 8 недель после последней процедуры с НТПАД. Для того, чтобы исследовать побочные эффекты от процедур с плазмой, терапевтом оценивались симптомы испытуемых. Масштаб покраснения, отека, болевых ощущений, кровоточивости, шелушений, поствоспалительной гиперпигментации и появление шрамов оценивались в рамках каждого осмотра, используя аналоговую таблицу с баллами от 0 до 3 (0: отсутствие побочных эффектов, 1: умеренные, 2: средние, 3: серьезные).
Замеры порфирина
После умывания и 30 минутной акклиматизации испытуемых были сделали ультрафиолетовые снимки с применением системы для анализа снимков кожи Mark-Vu («ПСИ Плюс» (PSI Plus) г. Сувон, Южная Корея) до начала первой процедуры (0 неделя) и через 2 недели после третьей процедуры с применением плазмы (неделя 2).
Себум и порфирины подсвечиваются голубым и оранжевым, соответственно, при ультрафиолетовом освещении. Прежде всего, чтобы проанализировать количество себума в зоне U (зона щек и лба) и частично в Т зоне (нос), было рассчитано процентное соотношение зоны, занимаемой голубым цветом. Количество порфирина было подсчитано делением каждого канала аддитивного цветового пространства и выражено в процентном соотношении к общему количеству себума.
Себум и порфирины подсвечиваются голубым и оранжевым, соответственно, при ультрафиолетовом освещении. Прежде всего, чтобы проанализировать количество себума в зоне U (зона щек и лба) и частично в Т зоне (нос), было рассчитано процентное соотношение зоны, занимаемой голубым цветом. Количество порфирина было подсчитано делением каждого канала аддитивного цветового пространства и выражено в процентном соотношении к общему количеству себума.
Замер уровней себума на лице
Затем был измерен уровень себума на лбу (средняя часть надпереносья), правой и левой щеках (над скуловой костью на линии зрачка). Интенсивность секреции себума, которая отображает количество выработанного себума за 60 минут, также была измерена. Количество себума до начала процедур было замерено сразу же после умывания. Испытуемые оставались в той же самой комнате с контролируемой средой в течение 60 минут.
После этого был проведен второй замер уровня себума (через 60 минут). Интенсивность секреции себума была рассчитана при помощи разницы между уровнями себума до начала процедуры и 60 минут после первого замера.
После этого был проведен второй замер уровня себума (через 60 минут). Интенсивность секреции себума была рассчитана при помощи разницы между уровнями себума до начала процедуры и 60 минут после первого замера.
Биопсия кожи, окрашивание гематоксилином и эозином, иммуногистохимическое исследование и иммунофлюоресцентное окрашивание
Панч-биопсия кожи (3 мм) была взята в зоне над скуловой костью у 2 из 15 волонтеров, кто принял участие в исследовании, спустя 2 недели после процедуры с аргоновой и азотной НТПАД. Срезы кожи были помещены между слоями парафина (4 мкм), затем очищены от парафина с помощью ксилола, восстановлены в серии процедур с этиловым спиртом и помещены в инкубаторный буфер («Новокастра» (Novocastra), Ньюкасл-апон-Тайн, Великобритания; 3% перекись водорода) на 20 минут при комнатной температуре. Срезы прошли инкубацию в течение ночи при 40С с антителами кролика к иммуноглобулинам мыши Ki67 (1:200, «Абкэм», Abcam, г. Кэмбридж, штат Массачусетс, США, #ab15580), поликнональными антителами кролика к 4-Гидроксинонену (4-HNE) (1:100, «Абкэм», Abcam, г. Кэмбридж, штат Массачусетс, США, #ab46545) и поликнональными антителами кролика к анти-PPAR (1:100, «Абкэм», Abcam, г. Кэмбридж, штат Массачусетс, США, #ab46545) и затем трижды промыты с фосфатно-солевым буфером (ФСБ). Срезы прошли инкубацию с антителами к IgG кролика, конъюгированными с пероксидазой хрена («Дэйко», Dako, г. Карпинтерия, штат Калифорния, США, #K4063) при комнатной температуре в течение 60 минут. Для окрашивания к Ki67 срезы прошли обработку диаминобензидином в течение 5-10 минут после промывки, затем промыты снова. Срезы были окрашены гематоксилином и эозином. Антитела кролика к IgG мыши, конъюгированные с Alexa Fluor 488 («Термо Фишер Сайентифик» (Thermo Fisher Scientific)), использовались как вторичные антитела для окрашивания 4-HNE PPARγ. Снимки были сделаны конфокальным микроскопом LSM 780 («Карл Цайс», Carl Zeiss).
Себоцитная клеточная культура и процедура с НТПАД
Иммортализованная линия клеток сальных желез человека SZ9516 была культивирована в среде Игла в модификации Дульбекко (СИМД)/F-12 c 2 ммоль GlutaMAX I, 10 мкм/мл гентамицин, 50 мкг/мл фактора роста, 10% сыворотки эмбриона теленка и 10 ммоль 4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота (все закуплены у «Гибро БРЛ» (Gibco BRL), г. Роквил, штат Мэриленд, США) и продержана при температуре в 370С и 5% СО2. Среда была заменена 2 дня спустя. Себоциты SZ95 были рассажены в 6-луночные плашки, за ночь почти достигнуто 90% слияние. Чтобы стимулировать липогенез, себоциты обрабатывались сочетанием 2 х 10-8 М тестостерона и 10-4 м линолевой кислоты (Т/ЛК) на протяжении 48 ч.
Все получившиеся субстанции были разведены с помощью диметилсульфоксида (ДМСО) и затем разведены еще раз с культурной средой (итоговая концентрация ДМСО составила 0.1%). Импульсы аргоновой и азотной НТПАД были доставлены к себоцитам сразу или спустя 24 часа после обработки Т/ЛК. 20 или 60 прохождений импульсами аргоновой НТПАД при 0.75 Дж и длительности импульса в 11 мс, или 5 или 10 прохождений азотной НТПАД при 1.5 Дж при длительности импульса в 13 мс были осуществлены для каждой лунки на расстоянии 5 мм. Для того чтобы гарантировать идентичность условий эксперимента, все замеры были выполнены в культурной среде при комнатной температуре.
Все получившиеся субстанции были разведены с помощью диметилсульфоксида (ДМСО) и затем разведены еще раз с культурной средой (итоговая концентрация ДМСО составила 0.1%). Импульсы аргоновой и азотной НТПАД были доставлены к себоцитам сразу или спустя 24 часа после обработки Т/ЛК. 20 или 60 прохождений импульсами аргоновой НТПАД при 0.75 Дж и длительности импульса в 11 мс, или 5 или 10 прохождений азотной НТПАД при 1.5 Дж при длительности импульса в 13 мс были осуществлены для каждой лунки на расстоянии 5 мм. Для того чтобы гарантировать идентичность условий эксперимента, все замеры были выполнены в культурной среде при комнатной температуре.
Оценка жизнеспособности клеток
Себоциты SZ95 были рассажены в 6-луночные плашки с плотностью 2 х 105 клеток/лунка и оставлены на ночь для культивирования. Клетки подверглись излучению 20 или 60 импульсов аргоновой НТПАД при 0.75 Дж, и 5 или 10 импульсам азотной НТПАД при 1.5 Дж, и затем прошли инкубацию в 48 часов. Затем клетки инкубировали с 5 мг/мл МТТ реагентом (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромид) в течение 2 часов. Раствор МТТ был убран и вместо него добавили 200 мкл ДМСО для растворения кристаллов формазана. Оптическая плотность (ОП) была измерена на участке в 540 нм с помощью спектрофотометра.
Иммуноцитохимия
Себоциты SZ95 были выращены на покровных стеклах, зафиксированы в ацетоне, пермеабилизированы с 0.1% Triton X-100 («Сигма-Алдрич» (Sigma Aldrich), г. Сент Луис, штат Миссури, США) в ФБС и затем инкубированы с Ki67 антителами кролика к IgG мыши (1:200, Abcam, #AB15580) в течение 60 минут при температуре в 370 °С (раствор 1:200).
В дальнейшем срезы были инкубированы с вторичными антителами козы к IgG кролика, конъюгированными с зеленым флуоресцентным красителем ФИТЦ («Санта Крус Биотекнолоджи» (Santa Cruz Biotechnology), г. Санта-Круз, штат Калифорния, США) (раствор 1:100), в течение 30 минут при комнатной температуре, ядра были визуализированы с пропидиумом иодида (ПИ) («Вектор» (Vector). Клетки были изучены при помощи конфокального микроскопа LSM 780 («Карл Цайс», Carl Zeiss).
В дальнейшем срезы были инкубированы с вторичными антителами козы к IgG кролика, конъюгированными с зеленым флуоресцентным красителем ФИТЦ («Санта Крус Биотекнолоджи» (Santa Cruz Biotechnology), г. Санта-Круз, штат Калифорния, США) (раствор 1:100), в течение 30 минут при комнатной температуре, ядра были визуализированы с пропидиумом иодида (ПИ) («Вектор» (Vector). Клетки были изучены при помощи конфокального микроскопа LSM 780 («Карл Цайс», Carl Zeiss).
Определение межклеточных липидов
Для количественного замера сальных липидов были культивированы себоциты SZ95 (15 000 клеток/лунка) в 96-луночной плашке («Грейнер Био Уан» (Greiner Bio One), г. Фрикенхаузен, Германия) в четырех экземплярах. Позже они были обработаны Т/ЛК с или без импульсов плазмы. Кондиционированные среды были удалены и 100 мкл из 1мкг/мл раствора Нильского красного (Sigma-Aldrich) были добавлены в каждую лунку. Плашки инкубировали при температуре в 370С в течение 20 минут, выпущенная флуоресценция была измерена устройством для микропланшетов, считывающим флуоресцентные изображения Molecular Devices FlexStation 384II («Молекьюла Девайсис» (Molecular Devices), г. Сан-Франциско, штат Калифорния, США).
Результаты были представлены в виде процентов абсолютных выходов флуоресценции в сравнении с контрольными, при возбуждении и эмиссии длины волны в 485 и 565 нм, соответственно, для нейтральных липидов. Для определения липидных капель с помощью микроскопического исследования 4% фиксированных с ПФА клеток были инкубированы с 4,4-Дифтор-1,3,5,7,8- пентаметил-4-бора-3a, 4a-диаза-s-индацен 493/503 флуоресцентное липидное пятно (10 мкг/мл в ФБР, BODIPY; Thermo Fisher Scientific, г. Уолтам, штат Массачусетс, США) в течение 7 минут при температуре в 370С. После инкубации эти срезы были промыты с 0.5% растворе бычьего сывороточного альбумина в ФСБ и рассмотрены с помощью люминесцентной микроскопии. Снимки были сделаны конфокальным микроскопом LSM 780 («Карл Цайс», Carl Zeiss).
Количественная цепная полимеразная реакция в живом времени РНК была извлечена из себоцитов SZ95 с помощью реагента TRIzoL (Thermo Fisher Scientific) в соответствии с протоколом производителя. РНК была выражена в количественной форме с помощью NanoDrop 2000c (Thermo Fisher Scientific) и кДНК была синтезирована с помощью набора для синтезирования кДНК (Thermo Fisher Scientific). Исследование цепной полимеразной реакции TaqMan в реальном времени было проведено с целью проанализировать уровни иРНК («Эпплайд Биосистемс» (Applied Biosystems), г. Фостер Сити, штат Калифорния, США). При этом использовались пробы TaqMan на предмет PPARγ и белок-1, связывающий стериновый регуляторный элемент. Относительный уровень экспрессии был нормализован для среднего значения ГАФДГ иРНК.
Результаты были представлены в виде процентов абсолютных выходов флуоресценции в сравнении с контрольными, при возбуждении и эмиссии длины волны в 485 и 565 нм, соответственно, для нейтральных липидов. Для определения липидных капель с помощью микроскопического исследования 4% фиксированных с ПФА клеток были инкубированы с 4,4-Дифтор-1,3,5,7,8- пентаметил-4-бора-3a, 4a-диаза-s-индацен 493/503 флуоресцентное липидное пятно (10 мкг/мл в ФБР, BODIPY; Thermo Fisher Scientific, г. Уолтам, штат Массачусетс, США) в течение 7 минут при температуре в 370С. После инкубации эти срезы были промыты с 0.5% растворе бычьего сывороточного альбумина в ФСБ и рассмотрены с помощью люминесцентной микроскопии. Снимки были сделаны конфокальным микроскопом LSM 780 («Карл Цайс», Carl Zeiss).
Количественная цепная полимеразная реакция в живом времени РНК была извлечена из себоцитов SZ95 с помощью реагента TRIzoL (Thermo Fisher Scientific) в соответствии с протоколом производителя. РНК была выражена в количественной форме с помощью NanoDrop 2000c (Thermo Fisher Scientific) и кДНК была синтезирована с помощью набора для синтезирования кДНК (Thermo Fisher Scientific). Исследование цепной полимеразной реакции TaqMan в реальном времени было проведено с целью проанализировать уровни иРНК («Эпплайд Биосистемс» (Applied Biosystems), г. Фостер Сити, штат Калифорния, США). При этом использовались пробы TaqMan на предмет PPARγ и белок-1, связывающий стериновый регуляторный элемент. Относительный уровень экспрессии был нормализован для среднего значения ГАФДГ иРНК.
Статистический анализ
Статистический анализ был выполнен с помощью программного обеспечения Prism 6 (GraphPad) и R, версия 3.4.3. Все тесты проводились на основе двустороннего критерия. Также двухвыборочный t-критерий для независимых выборок применялся для сравнения данных двух групп. Статистическая значимость установлена на при *P < 0.05, **P < 0.01, где планки погрешности представляют стандартную ошибку среднего.
Материалы и методы
05
06
Список литературы
Парк Дж. и др. Нетермическая плазма атмосферного давления способствует быстрому росту стволовых клеток жировой ткани путем отрицательной иммунной реакции. Журнал: Sci Rep, 6, 39298.
Ган Л. и др. Медицинское применение нетермической плазмы атмосферного давления в дерматологии Журнал:Dtsch Dermatol Ges.
Чен К.Я., Лин Дж.Х., Чен Ю.П., Чиу Х.И., Йе Н.Л., Ву Т.К. и др. Лечение ран с применением плазменных струй атмосферного давления у крыс с диабетом, вызванным стрептозотоцином. Журнал: Sci Rep 2018; 8:12214.
Хейнлин Дж., и др. Рандомизированное экспериментальное исследование с применением плацебо холодной атмосферной аргоновой плазмы на донорских участках кожи для трансплантации. Журнал: Wound Repair Regen. 2013; 21:800‐807.
Кубинова С. и др. Технология нетермической плазмы эффективна при лечении серьезных ранах на коже крыс. Журнал: Sci Rep, 7, 45183
Лиу Дж.Р., Сю Г.М., Ши С.М., Джан Г.Дж. Низкотемпературная плазма способствует пролиферации фибробластов путем стимулирования транскрипционного фактора NF-κB и увеличению Циклина D1. Журнал: Sci Rep. 2017; 7:11698
Вейандт Г.Х., Бенойт С., Бекер Дж. К., Брокер Э.Б., Хамм Х. Контролируемое удаление аногенительных бородавок на разных слоях ткани кожи с применением коагуляции, вызванной аргоновой плазмой. Журнал: Dtsch Dermatol Ges, 3, 271–275
Виганд К. и др. Журнал: Антимикробное воздействие на различные виды дрожжей и бактерий в медицине с применением технологии холодной плазмы атмосферного давления. Журнал: Skin Pharmacol Physiol. 2014; 27:25‐35.
Элзе М.Л., Каммер Дж.Н. Оценка эффективности технологий плазменной регенерации при ремоделировании кожи лица. Журнал: Cosmet Dermatol. 2008; 7:309‐311.
Фитцпатрик Р. и др. Гистопатологическая оценка системы плазменной регенерации кожи (PSR) и стандартного СО2 лазера для восстановления кожи у животных. Журнал: Lasers Surg Med, 40, 93–99.
Килмер С., Семчишин Н., Шах Г., Фитцпатрик Р. Экспериментальное исследование применения аппарата плазменной регенерации кожи (Portrait PSR3) для полного(глубокого) омоложения лица. Журнал: Lasers Med Sci, 22, 101–109.
Ким Х., Ким Х.Дж., Ким Х.К., Хон Дж. Я., Чу С.Б. Результат применения аргоновой и азотной плазм на кожи и ей придатков у животных. Журнал: Skin Res Technol, 26, 81–90.
Корнелиус К.Э. Третий, Людвиг Г.Д. Красная флуоресцентная диагностика комедонов: распространение порфиринов, вызванное пропионибактериями акне. The Journal of investigative dermatology, 49, 368–370 (1967).
МкКингли К.Дж., Уэбстер Г.Ф., Лейден Дж.Дж. Фолликулярная и порфириновая флуоресценция на кожи лица: соотношение возраста и Propionibacterium acnes. Журнал: British journal of dermatology, 102, 437–441.
Бауэр Г., Серзенова Д., Гравес Д. Б., Мачала Холодная плазма атмосферного давления и плазмоактивированный сигнал средней мощности для удаления апоптоза клеток опухоли, вызванного рецептором RON. Журнал: Sci Rep, 9, 1421
Зубулис К.К., Селтманн Х., Нейтзел Х., Орфанос К.Э. Иммортализированная клеточная линия сальных желез (SZ95).
Журнал: The Journal of investigative dermatology,113, 1011–1020
Боурк П., Зиузина Д., Хан Л., Каллен П.Дж., Гилмор Б.Ф. Микробиологическое взаимодействие с холодной плазмой. Журнал: Appl Microbiol, 123, 308–324
Дэшлайн Г. и др. Восприимчивость в условиях in vitro кожных патогенов и кожи, устойчивой ко многим лекарственным препаратам, к низкотемпературной плазме атмосферного давления и плазмы диэлектрического барьерного разряда.
Журнал: Plasma Processes and Polymers, 11, 175–183 (2014).
Исбэри Г. и др. Эффективное и безопасное использование холодной аргоновой плазмы атмосферного давления в течение 2 минут при лечение хронических ран: результаты рандомизированного контролируемого исследования.
Журнал: The British journal of dermatology, 167, 404–410. (2012).
Сун К.Дж. и др. Корейская система оценки акне. Журнал: Korean Journal of Dermatology, 42, 1241–1247 (2004).
(Небольшой Н) Авторы
Сан Бин Чо — Клиника Дерматологии и лазерных технологий Yonsei Seran, г. Сеул, Корея
Сён-Жу Ли — Университетский медицинский колледж Ёнсе
Дае Сан Йу — Университетский медицинский колледж Ёнсе
Сон-И Ким — Университетский медицинский колледж Ёнсе
Кристос К. Зубулис — Брандербургский медицинский университет имени Теодора Фонтейна
Сан Иун Ли — Университетский медицинский колледж Ёнсе
Ган Л. и др. Медицинское применение нетермической плазмы атмосферного давления в дерматологии Журнал:Dtsch Dermatol Ges.
Чен К.Я., Лин Дж.Х., Чен Ю.П., Чиу Х.И., Йе Н.Л., Ву Т.К. и др. Лечение ран с применением плазменных струй атмосферного давления у крыс с диабетом, вызванным стрептозотоцином. Журнал: Sci Rep 2018; 8:12214.
Хейнлин Дж., и др. Рандомизированное экспериментальное исследование с применением плацебо холодной атмосферной аргоновой плазмы на донорских участках кожи для трансплантации. Журнал: Wound Repair Regen. 2013; 21:800‐807.
Кубинова С. и др. Технология нетермической плазмы эффективна при лечении серьезных ранах на коже крыс. Журнал: Sci Rep, 7, 45183
Лиу Дж.Р., Сю Г.М., Ши С.М., Джан Г.Дж. Низкотемпературная плазма способствует пролиферации фибробластов путем стимулирования транскрипционного фактора NF-κB и увеличению Циклина D1. Журнал: Sci Rep. 2017; 7:11698
Вейандт Г.Х., Бенойт С., Бекер Дж. К., Брокер Э.Б., Хамм Х. Контролируемое удаление аногенительных бородавок на разных слоях ткани кожи с применением коагуляции, вызванной аргоновой плазмой. Журнал: Dtsch Dermatol Ges, 3, 271–275
Виганд К. и др. Журнал: Антимикробное воздействие на различные виды дрожжей и бактерий в медицине с применением технологии холодной плазмы атмосферного давления. Журнал: Skin Pharmacol Physiol. 2014; 27:25‐35.
Элзе М.Л., Каммер Дж.Н. Оценка эффективности технологий плазменной регенерации при ремоделировании кожи лица. Журнал: Cosmet Dermatol. 2008; 7:309‐311.
Фитцпатрик Р. и др. Гистопатологическая оценка системы плазменной регенерации кожи (PSR) и стандартного СО2 лазера для восстановления кожи у животных. Журнал: Lasers Surg Med, 40, 93–99.
Килмер С., Семчишин Н., Шах Г., Фитцпатрик Р. Экспериментальное исследование применения аппарата плазменной регенерации кожи (Portrait PSR3) для полного(глубокого) омоложения лица. Журнал: Lasers Med Sci, 22, 101–109.
Ким Х., Ким Х.Дж., Ким Х.К., Хон Дж. Я., Чу С.Б. Результат применения аргоновой и азотной плазм на кожи и ей придатков у животных. Журнал: Skin Res Technol, 26, 81–90.
Корнелиус К.Э. Третий, Людвиг Г.Д. Красная флуоресцентная диагностика комедонов: распространение порфиринов, вызванное пропионибактериями акне. The Journal of investigative dermatology, 49, 368–370 (1967).
МкКингли К.Дж., Уэбстер Г.Ф., Лейден Дж.Дж. Фолликулярная и порфириновая флуоресценция на кожи лица: соотношение возраста и Propionibacterium acnes. Журнал: British journal of dermatology, 102, 437–441.
Бауэр Г., Серзенова Д., Гравес Д. Б., Мачала Холодная плазма атмосферного давления и плазмоактивированный сигнал средней мощности для удаления апоптоза клеток опухоли, вызванного рецептором RON. Журнал: Sci Rep, 9, 1421
Зубулис К.К., Селтманн Х., Нейтзел Х., Орфанос К.Э. Иммортализированная клеточная линия сальных желез (SZ95).
Журнал: The Journal of investigative dermatology,113, 1011–1020
Боурк П., Зиузина Д., Хан Л., Каллен П.Дж., Гилмор Б.Ф. Микробиологическое взаимодействие с холодной плазмой. Журнал: Appl Microbiol, 123, 308–324
Дэшлайн Г. и др. Восприимчивость в условиях in vitro кожных патогенов и кожи, устойчивой ко многим лекарственным препаратам, к низкотемпературной плазме атмосферного давления и плазмы диэлектрического барьерного разряда.
Журнал: Plasma Processes and Polymers, 11, 175–183 (2014).
Исбэри Г. и др. Эффективное и безопасное использование холодной аргоновой плазмы атмосферного давления в течение 2 минут при лечение хронических ран: результаты рандомизированного контролируемого исследования.
Журнал: The British journal of dermatology, 167, 404–410. (2012).
Сун К.Дж. и др. Корейская система оценки акне. Журнал: Korean Journal of Dermatology, 42, 1241–1247 (2004).
(Небольшой Н) Авторы
Сан Бин Чо — Клиника Дерматологии и лазерных технологий Yonsei Seran, г. Сеул, Корея
Сён-Жу Ли — Университетский медицинский колледж Ёнсе
Дае Сан Йу — Университетский медицинский колледж Ёнсе
Сон-И Ким — Университетский медицинский колледж Ёнсе
Кристос К. Зубулис — Брандербургский медицинский университет имени Теодора Фонтейна
Сан Иун Ли — Университетский медицинский колледж Ёнсе
Читайте статьи:
30 Июня 2024
Новые технологии красоты


30 Июня 2024
Новые технологии красоты


30 Июня 2024
Новые технологии красоты


Все статьи из блога
Все статьи из блога









