

Оставить заявку
Оставить заявку

ОСТАВИТЬ ЗАЯВКУ
Заполняя данную форму, вы соглашаетесь с Правилами обработки персональных данных
Влияние мультипептидных факторов, полученных из фибробластов человека, на пролиферацию и миграцию фибробластов кожи человека, обработанных азотной плазмой
20 Августа 2025
Новые технологии красоты


01
Введение
Мультипептидные факторы, полученные из фибробластов человека (МПФ), играют ключевую роль в рекрутинге, адгезии, присоединении, миграции и пролиферации клеток в процессе заживления ран. Дермальные фибробласты демонстрируют высоковариативный характер секреции МПФ, который зависит от рассматриваемого биологического вида и анатомической зоны. Субпопуляции фибробластов оказывают влияние на различные аспекты пролиферации и дифференциации эпидермиса и дермы.
Свежекультивированные дермальные заменители вырабатывают высокие уровни фактора роста эндотелия сосудов (VEGF), основного фактора роста фибробластов (bFGF), фактора роста гепатоцитов (HGF), тромбоцитарного фактора роста АА (PDGF-AA), трансформирующего фактора роста бета-1 (TGF-β1), фактора роста кератиноцитов (KGF), интерлейкина-6 (IL-6) и интерлейкина-8 (IL-8) в культивированных аллогенных дермальных заменителях, содержащих фибробласты. Кондиционированная среда фибробластов человека (КСФЧ) также содержит МПФ, полученные из фибробластов человека. Протеомные исследования отмечают наличие других белков, в т. ч. сывороточного альбумина, альфа-фетопротеина (аФП), альфа-2-HS-гликопротеина, альфа-2-макроглобулина, коллагена 1 типа альфа-1 (COL1A1), COL4A1, COL12A1, декорина, фибронектина, фибулина-1, ингибитора интер-альфа-трипсина тяжелой цепи H2, лакто-трансферрина, нуклеобиндина-1, пентраксина-3, фактора дифференцировки из пигментного эпителия; ассоциированного с беременностью, альфа-2-гликопротеина, белка ig-h3, индуцированного трансформирующим фактором роста-бета (TGFBI/βig-H3), и тромбоспондина-1.
С целью стимуляции секреции МПФ в дерме для лечения кожи, поврежденной ультрафиолетом, или омоложения были использованы процедуры, основанные на доставке энергии. Такие источники энергии также могут способствовать транспортировке медикаментов в эпидермис или сосочковый слой дермы.
По сравнению с другими методами нетермическая азотная плазма атмосферного давления может способствовать термической коагуляции тканей и изменениям в коже, зависящим от подаваемой энергии и не зависящим от хромофор. Азотная плазма демонстрирует терапевтическую эффективность при лечении фотостарения кожи с пигментацией и без нее.
В настоящем исследовании мы оценили воздействие кондиционированной среды фибробластов человека (КСФЧ) с МПФ, полученных из фибробластов человека (КСФЧ-МПФ), на пролиферацию дермальных фибробластов человека (ДФЧ), заранее обработанных бесконтактным и неаблятивным способом доставки энергии. Для этого мы использовали импульсы нетермической азотной плазмы атмосферного давления на низкоэнергетических и высокоэнергетических настройках для обработки ДФЧ, культивированных в различных средах. Свойства пролиферации клеток и заживления ран были серийно измерены с использованием 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2H-тетразолия (MTS-тест) и в рамках анализа методом зарастания царапины.
Свежекультивированные дермальные заменители вырабатывают высокие уровни фактора роста эндотелия сосудов (VEGF), основного фактора роста фибробластов (bFGF), фактора роста гепатоцитов (HGF), тромбоцитарного фактора роста АА (PDGF-AA), трансформирующего фактора роста бета-1 (TGF-β1), фактора роста кератиноцитов (KGF), интерлейкина-6 (IL-6) и интерлейкина-8 (IL-8) в культивированных аллогенных дермальных заменителях, содержащих фибробласты. Кондиционированная среда фибробластов человека (КСФЧ) также содержит МПФ, полученные из фибробластов человека. Протеомные исследования отмечают наличие других белков, в т. ч. сывороточного альбумина, альфа-фетопротеина (аФП), альфа-2-HS-гликопротеина, альфа-2-макроглобулина, коллагена 1 типа альфа-1 (COL1A1), COL4A1, COL12A1, декорина, фибронектина, фибулина-1, ингибитора интер-альфа-трипсина тяжелой цепи H2, лакто-трансферрина, нуклеобиндина-1, пентраксина-3, фактора дифференцировки из пигментного эпителия; ассоциированного с беременностью, альфа-2-гликопротеина, белка ig-h3, индуцированного трансформирующим фактором роста-бета (TGFBI/βig-H3), и тромбоспондина-1.
С целью стимуляции секреции МПФ в дерме для лечения кожи, поврежденной ультрафиолетом, или омоложения были использованы процедуры, основанные на доставке энергии. Такие источники энергии также могут способствовать транспортировке медикаментов в эпидермис или сосочковый слой дермы.
По сравнению с другими методами нетермическая азотная плазма атмосферного давления может способствовать термической коагуляции тканей и изменениям в коже, зависящим от подаваемой энергии и не зависящим от хромофор. Азотная плазма демонстрирует терапевтическую эффективность при лечении фотостарения кожи с пигментацией и без нее.
В настоящем исследовании мы оценили воздействие кондиционированной среды фибробластов человека (КСФЧ) с МПФ, полученных из фибробластов человека (КСФЧ-МПФ), на пролиферацию дермальных фибробластов человека (ДФЧ), заранее обработанных бесконтактным и неаблятивным способом доставки энергии. Для этого мы использовали импульсы нетермической азотной плазмы атмосферного давления на низкоэнергетических и высокоэнергетических настройках для обработки ДФЧ, культивированных в различных средах. Свойства пролиферации клеток и заживления ран были серийно измерены с использованием 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2H-тетразолия (MTS-тест) и в рамках анализа методом зарастания царапины.
02
Материалы и методы
Культивирование ДФЧ и приготовление КСФЧ-МПФ
Неонатальные ДФЧ (произв. «Лонза» (Lonza), г. Уолкерсвилл, штат Мэриленд, США) были смешаны с питательной средой для роста фибробластов (произв. Lonza) в пропорции 1:1. Клетки были высажены в колбу Т-75 и инкубированы в течение ночи при температуре 37 °C и уровне CO2 5%. Далее мы заменили имеющуюся среду на Opti-МЕМ (произв. «Гибко БиАрЭл» (Gibco BRL), г. Роквилл, штат Мэриленд, США) для создания условий среды с пониженным содержанием сыворотки, и культивировали клетки в течение 24 ч до достижения конфлюентности примерно 90%. Затем клетки были промыты фосфатно-солевым буферным раствором Дульбекко (произв. «Санта Круз Биотекнолоджи» (Santa Cruz Biotechnology), г. Санта-Круз, штат Калифорния, США) и обработаны 0,15% р-ром трипсина (произв. Gibco BRL) на протяжении 5 мин при 37 °C для отсоединения клеток от поверхности колбы. Для остановки действия трипсина мы добавили среду, после чего клетки были помещены в центрифугу на 5 минут. Собранные клетки были перерастворены в Opti-MEM и распределены в колбы T-75. Рост клеток продолжался, пока мы не получили достаточное количество клеток для проведения эксперимента. Для приготовления КСФЧ-МПФ, ДФЧ (пассаж 5−7) были культивированы в колбах Т-175 со средой Opti-MEM с добавлением 2 ммоль GlutaMAX, 2 нг/мл рекомбинантного эпидермального фактора роста человека и 2 нг/мл рекомбинантного фактора роста фибробластов человека (Opti-MEM+G+GFs; произв. Lonza) без добавления эмбриональной телячьей сыворотки. Клетки инкубировались при температуре 37 °C в 5% CO2-инкубаторе на протяжении 24 ч, и среда была отобрана в виде КСФЧ-МПФ.
Обработка ДФЧ азотной плазмой
В данном исследовании мы использовали генератор нетермической плазмы атмосферного давления (торговая марка PLADUO; произв. ООО «Шенб Ко. Лтд.» (Shenb Co., Ltd.), г. Сеул, Корея) для выработки импульсов азотной плазмы из инертного газа. Для этого газообразный азот в невозбужденном состоянии подавался в дистальный конец манипулы, и микроволновая энергия с частотой в 2,45 гГц преобразовывала подаваемый газ в плазму внутри манипулы. Объем подачи газа и длительность импульса были установлены на значениях 0,2−1,42 мл/импульс и 5−36 мс при 0,5−4 Дж/импульс. Давление импульса азотной плазмы равнялось 1,0−1,2 бар.
Для оценки пролиферации клеток ДФЧ были высажены в 96-луночный планшет со средой Opti-MEM и инкубированы на протяжении 24 ч при температуре 37 °C и уровне CO2 5%. Для оценки ранозаживляющих свойств клетки были высажены в чашки Петри с культуральной вставкой на 2 лунки (торговая марка «Ибиди» (ibidi); произв. ООО «Ибиди ГМБХ» (ibidi) GmbH, г. Мартинсрид, Германия), с плотностью клеток в 3×104 клеток на лунку. Клетки были инкубированы в течение ночи для прикрепления клеток. Далее ДФЧ были обработаны азотной плазмой при следующих параметрах процедуры: настройки подачи энергии — 1, 2, и 3 Дж, подаваемый объем газа — 0,4, 0,68, и 1,12 мл/импульс, длительность импульса —10, 17, и 28 мс, соответственно. Расстояние от кончика одноразовой насадки манипулы до дна чашки составило 5 мм, было подано три последовательных импульса с экспериментальными настройками на частоте 2 Гц. Каждый эксперимент повторялся трижды.
Для оценки пролиферации клеток ДФЧ были высажены в 96-луночный планшет со средой Opti-MEM и инкубированы на протяжении 24 ч при температуре 37 °C и уровне CO2 5%. Для оценки ранозаживляющих свойств клетки были высажены в чашки Петри с культуральной вставкой на 2 лунки (торговая марка «Ибиди» (ibidi); произв. ООО «Ибиди ГМБХ» (ibidi) GmbH, г. Мартинсрид, Германия), с плотностью клеток в 3×104 клеток на лунку. Клетки были инкубированы в течение ночи для прикрепления клеток. Далее ДФЧ были обработаны азотной плазмой при следующих параметрах процедуры: настройки подачи энергии — 1, 2, и 3 Дж, подаваемый объем газа — 0,4, 0,68, и 1,12 мл/импульс, длительность импульса —10, 17, и 28 мс, соответственно. Расстояние от кончика одноразовой насадки манипулы до дна чашки составило 5 мм, было подано три последовательных импульса с экспериментальными настройками на частоте 2 Гц. Каждый эксперимент повторялся трижды.
Оценка пролиферации и ранозаживляющих свойств
Оценка жизнеспособности ДФЧ, обработанных азотной плазмой, производилась путем MTS-теста (на реагенте Cell Titer 96 Aqueous One solution; произв. «Промега» (Promega), г. Мадисон, штат Висконсин, США), согласно инструкции производителя. Сразу после обработки азотной плазмой мы заменили среду в 96-луночном планшете на: 1) Opti-MEM с добавлением 2 ммоль GlutaMAX (Opti-MEM+G), 2) Opti-MEM+G+GFs, или 3) КСФЧ-МПФ, затем произвели культивацию в течение 0, 3, 6, 9, 12, и 24 ч. По прошествии указанного времени мы добавили 20 мкл реагента Cell Titer 96 Aqueous One Solution в каждую лунку и провели инкубацию при температуре 37 °C в течение 60 мин. Количество продуктов формазана определяли путем измерения абсорбции при 490 нм с помощью микропланшетного ридера (произв. Bio-Rad), каждое измерение было проведено три раза.
Для оценки ранозаживляющих свойств сразу после обработки азотной плазмой мы изъяли культуральные вставки и заменили среду на: 1) Opti-MEM+G, 2) Opti-MEM+G+GFs, или 3) КСФЧ-МПФ, затем провели культивацию в течение 0, 3, 6, 9, 12, и 24 ч. Снимки каждой чашки были сделаны в каждый указанный момент времени (t) при помощи фазово-контрастного микроскопа с увеличением в 40 раз (Olympus CKX53; произв. «Олимпус Лайф Саэнс» (Olympus Life Science), г. Токио, Япония). Ширина (W) и площадь раны были измерены при помощи программы ImageJ (разр. NIH, Бетесда, штат Мэриленд, США).Далее мы рассчитали скорость клеточной миграции (MR):
Для оценки ранозаживляющих свойств сразу после обработки азотной плазмой мы изъяли культуральные вставки и заменили среду на: 1) Opti-MEM+G, 2) Opti-MEM+G+GFs, или 3) КСФЧ-МПФ, затем провели культивацию в течение 0, 3, 6, 9, 12, и 24 ч. Снимки каждой чашки были сделаны в каждый указанный момент времени (t) при помощи фазово-контрастного микроскопа с увеличением в 40 раз (Olympus CKX53; произв. «Олимпус Лайф Саэнс» (Olympus Life Science), г. Токио, Япония). Ширина (W) и площадь раны были измерены при помощи программы ImageJ (разр. NIH, Бетесда, штат Мэриленд, США).Далее мы рассчитали скорость клеточной миграции (MR):
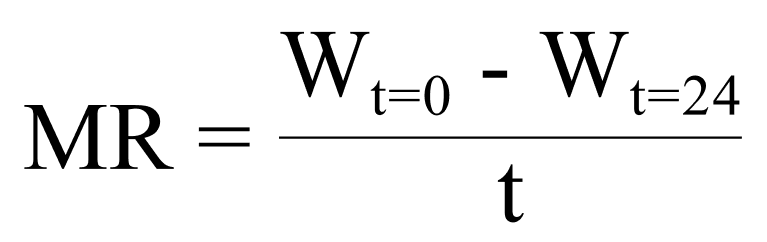
где W — средняя ширина раны (мкм), t — временной отрезок заживления раны (в часах).
В дополнение к этому мы рассчитали процент площади раны (WA%):
В дополнение к этому мы рассчитали процент площади раны (WA%):
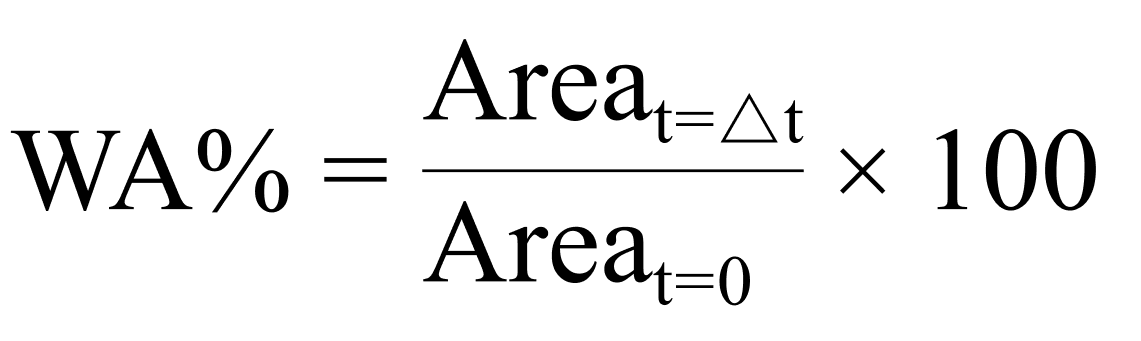
где Area — средняя площадь раны (мкм) при t=0 (начальная площадь раны), а t=∆t (площадь раны в определенный отрезок времени после ее обработки плазмой).
03
Статистический анализ
При помощи программы Prism 8.0 («ГрафПэд Софртвэа» (GraphPad Software), Сан-Диего, штат Калифорния, США) мы произвели статистический анализ значений, полученных при анализе пролиферации и ранозаживляющих свойств.
Многочисленные сравнения результатов экспериментальной группы клеток, обработанных азотной плазмой, и контрольной группы в разных условиях культивирования ДФЧ после обработки в разные моменты времени проводились путем двухфакторного дисперсионного анализа с post-hoc тестом Тьюки. Значения считались статистически значимыми в диапазоне *P < 0,05, **P < 0,001. Планки погрешностей указывают на стандартное отклонение.
Многочисленные сравнения результатов экспериментальной группы клеток, обработанных азотной плазмой, и контрольной группы в разных условиях культивирования ДФЧ после обработки в разные моменты времени проводились путем двухфакторного дисперсионного анализа с post-hoc тестом Тьюки. Значения считались статистически значимыми в диапазоне *P < 0,05, **P < 0,001. Планки погрешностей указывают на стандартное отклонение.
04
Результаты
Влияние азотной плазмы на ДФЧ было оценено после обработки азотной плазмой при настройках подачи энергии в 1, 2, и 3 Дж/импульс тремя последовательными импульсами и последующей культивации обработанных плазмой клеток и контрольных клеток и в среде Opti-MEM+G. MTS-тест показал, что обработка азотной плазмой при подачи энергии в 1 Дж/импульс не привела к каким-либо значительным изменениям жизнеспособности ДФЧ на всех отрезках времени по сравнению с клетками контрольной группы (Рис. 1A). Обработка азотной плазмой при подачи энергии в 2 Дж/импульс вызвала значительное снижение жизнеспособности ДФЧ только через 24 ч, а обработка при подачи энергии в 3 Дж/импульс вызвала значительное снижение жизнеспособности клеток через 12 и 24 ч. WA% необработанных ДФЧ, культивированных в Opti-MEM+G, значительно уменьшился через 24 ч по сравнению с 0 ч (Рис. 1B). При этом WA% заметно уменьшился через 9, 12, и 24 ч по сравнению с исходным значением после обработки плазмой при подачи энергии в 1 Дж/импульс; через 6 и 24 ч после обработки плазмой при подачи энергии в 2 Дж/импульс; через 12 и 24 ч после обработки плазмой при подачи энергии в 3 Дж/импульс (Рис. 2). Однако статистически значимые изменения WA% при разных значениях подачи энергии были отмечены только через 6 ч (Рис. 1C). Также мы оценили скорость миграции после обработки клеток азотной плазмой и последующей инкубации в Opti-MEM+G на протяжении 24 ч (Рис. 1D). Скорость миграции необработанных ДФЧ составила 0,0121 ± 0,115 мм/ч; 0,0124 ± 0,193 мм/ч после обработки ДФЧ плазмой при подачи энергии в 1 Дж/импульс, 0,0122 ± 0,388 мм/ч после обработки плазмой при подачи энергии в 2 Дж/импульс, 0,0127 ± 0,168 мм/ч после обработки плазмой при подачи энергии в 3 Дж/импульс. Статистически значимых различий между экспериментальными условиями обработки азотной плазмой обнаружено не было.
Влияние азотной плазмы на ДФЧ
Пролиферация обработанных плазмой ДФЧ, культивированных в КСФЧ-МПФ
В экспериментах со средой Opti-MEM+G+GFs MTS-тест показал, что обработка плазмой при подачи энергии в 1 и 2 Дж/импульс не вызывает значительного снижения жизнеспособности ДФЧ на всех отрезках времени по сравнению с контрольной группой (Рис. 3A). Жизнеспособность ДФЧ, обработанных плазмой при подачи энергии в 3 Дж/импульс, снизилась только через 24 ч. В экспериментах с культурой КСФЧ-МПФ, MTS-тест не показал значимого снижения жизнеспособности ДФЧ, обработанных плазмой при подачи энергии в 1 и 2 Дж/импульс во всех отрезках времени
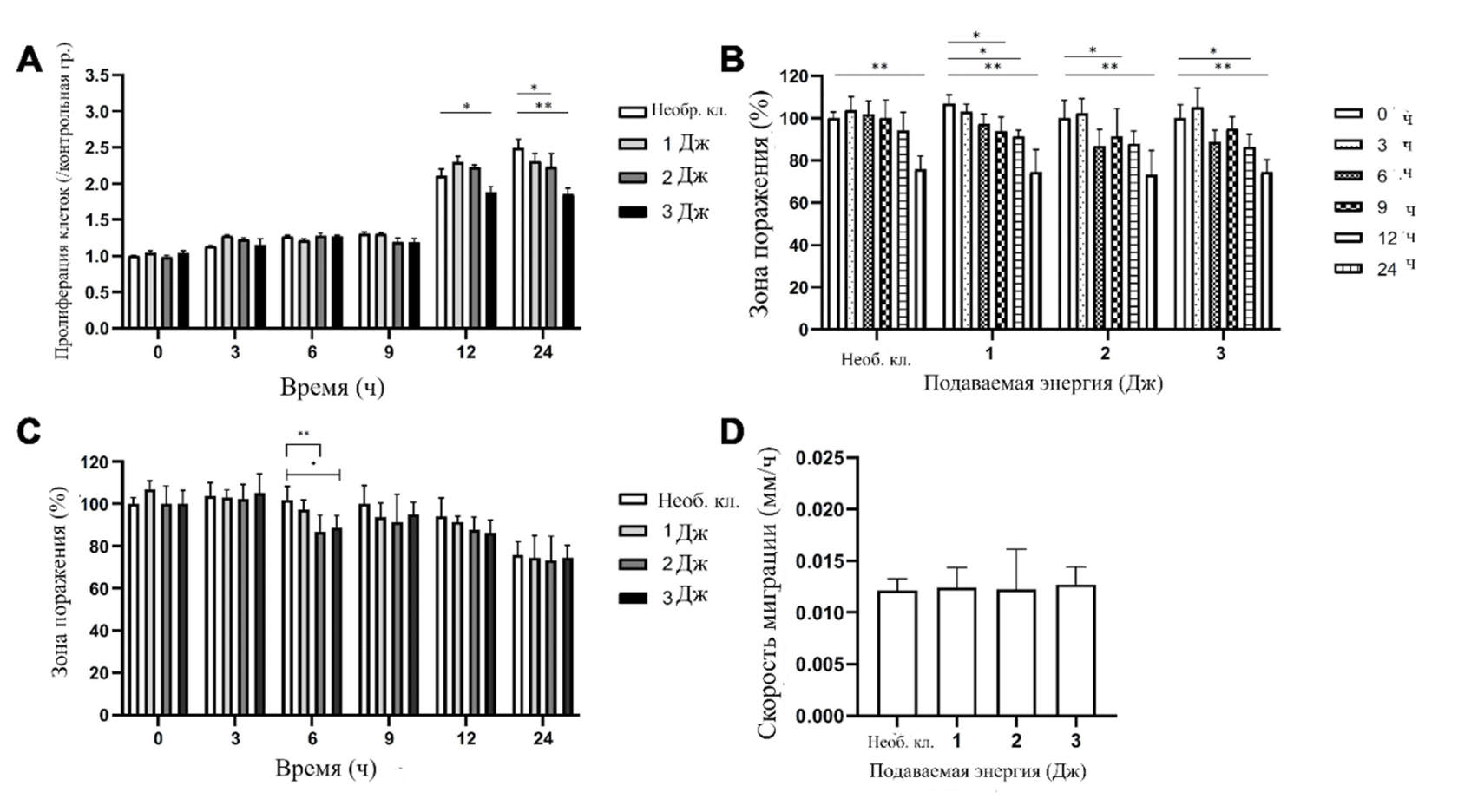
Рис. 1 Влияние азотной плазмы на дермальные фибробласты человека (ДФЧ). ДФЧ были обработаны тремя последовательными импульсами азотной плазмы при подаче энергии в 1, 2, и 3 Дж с последующей культивацией в среде Opti-MEM с добавлением GlutaMAX (Opti-MEM+G). Оценка (A) пролиферации и (B, C) ранозаживляющих свойств ДФЧ, обработанных азотной плазмой. Результаты были получены через 0, 3, 6, 9, 12 и 24 ч после обработки плазмой. (D) Скорость миграции клеток после обработки плазмой. Сравнение скорости миграции в группах клеток с различными значениями энергии подачи азотной плазмы. *P < 0,05, **P < 0,001.

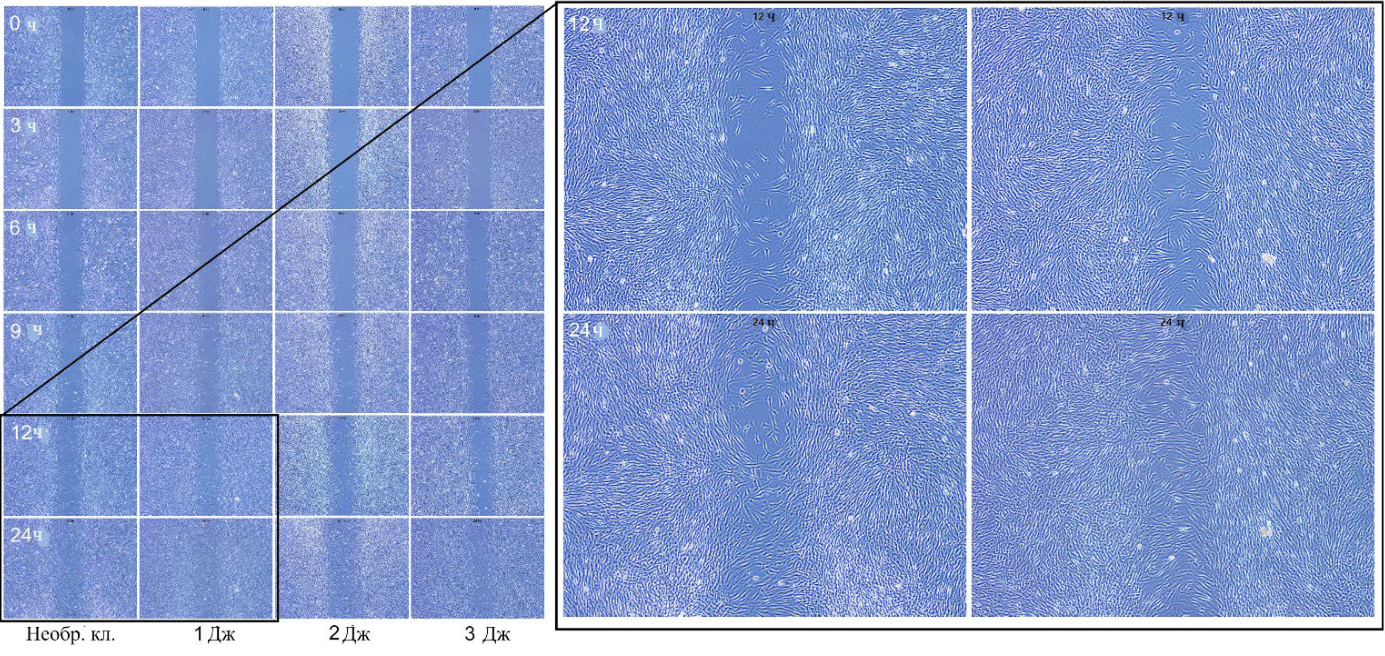
Рис. 2 Репрезентативная фотография анализа ранозаживляющих свойств. ДФЧ обрабатывались азотной плазмой при настройках подачи энергии в 1, 2 и 3 Дж с последующей культивацией в Opti-MEM+G. Снимки были сделаны под микроскопом через 0, 3, 6, 9, 12, и 24 ч после обработки азотной плазмой. Неокрашенные клетки, исходное увеличение изображения в 4 раза.
Однако жизнеспособность ДФЧ, обработанных при подачи энергии в 3 Дж/импульс и культивированных в КСФЧ-МПФ, все еще была значительно снижена через 24 ч.
Пролиферация контрольной группы клеток, культивированных в Opti-MEM+G+GFs и КСФЧ-МПФ, значительно увеличилась через 12 ч по сравнению с клетками, культивированными в Opti-MEM+G (Рис. 3C). Пролиферация ДФЧ, обработанных при настройках подачи энергии в 1 Дж/импульс и культивированных в Opti-MEM+G+GFs и КСФЧ-МПФ, увеличилась через 24 ч по сравнению с клетками, культивированными в Opti-MEM+G (Рис. 3D).
Пролиферация контрольной группы клеток, культивированных в Opti-MEM+G+GFs и КСФЧ-МПФ, значительно увеличилась через 12 ч по сравнению с клетками, культивированными в Opti-MEM+G (Рис. 3C). Пролиферация ДФЧ, обработанных при настройках подачи энергии в 1 Дж/импульс и культивированных в Opti-MEM+G+GFs и КСФЧ-МПФ, увеличилась через 24 ч по сравнению с клетками, культивированными в Opti-MEM+G (Рис. 3D).
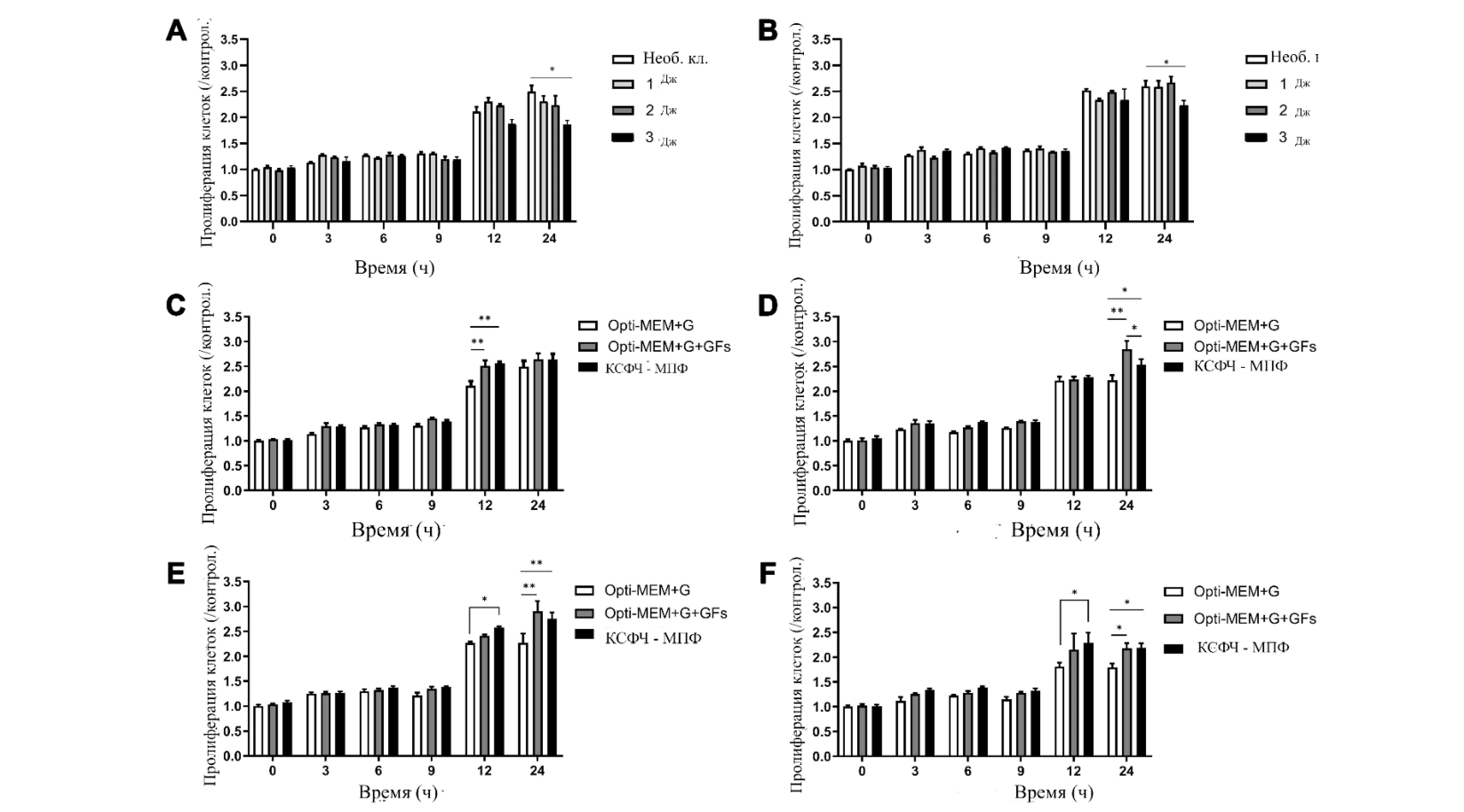
Рис. 3 Оценка прилиферации ДФЧ, обработанных плазмой в кондиционированной среде филробластов человека (КСФЧ) с мультипептидными факторами из фибробластов (КСФЧ-МПФ). ДФЧ были обработаны азотной плазмой с последующей культивацией в (A) Opti-MEM с добавлением GlutaMAX и рекомбинантными факторами роста фибробластов человека (Opti-MEM+G+GFs) и (B) КСФЧ-МПФ. Оценка пролиферации проводилась через 0, 3, 6, 9, 12 и 24 ч после © отсутствия обработки, (D) обработки при настройках подаваемой энергии в 1 Дж, (E) обработки при настройках подаваемой энергии в 2 Дж, и (F) обработки при настройках подаваемой энергии в 3 Дж. После обработки проводился сравнительный анализ данных в группах культуральных сред Opti-MEM+G, Opti-MEM+G+GFs и КСФЧ-МПФ. *P < 0,05, **P < 0,001. добавлением GlutaMAX и рекомбинантными факторами роста фибробластов человека (Opti-MEM+G+GFs) и (B) КСФЧ-МПФ. Оценка пролиферации проводилась через 0, 3, 6, 9, 12 и 24 ч после © отсутствия обработки, (D) обработки при настройках подаваемой энергии в 1 Дж, (E) обработки при настройках подаваемой энергии в 2 Дж, и (F) обработки при настройках подаваемой энергии в 3 Дж. После обработки проводился сравнительный анализ данных в группах культуральных сред Opti-MEM+G, Opti-MEM+G+GFs и КСФЧ-МПФ. *P < 0,05, **P < 0,001.
Пролиферация ДФЧ, обработанных при настройках в 2 Дж/импульс, увеличилась через 12 ч в КСФЧ-МПФ и через 24 ч в Opti-MEM+G+GFs и КСФЧ-МПФ по сравнению с пролиферацией клеток, культивируемых в Opti-MEM+G (Рис. 3E). Пролиферация ДФЧ, обработанных при настройках в 3 Дж/импульс, увеличилась через 12 ч в КСФЧ-МПФ и через 24 ч в Opti-MEM+G+GFs и КСФЧ-МПФ по сравнению с пролиферацией клеток, культивируемым в Opti-MEM+G (Рис. 3F).
Ранозаживляющие свойства обработанных плазмой ДФЧ, культивированных в КСФЧ-МПФ
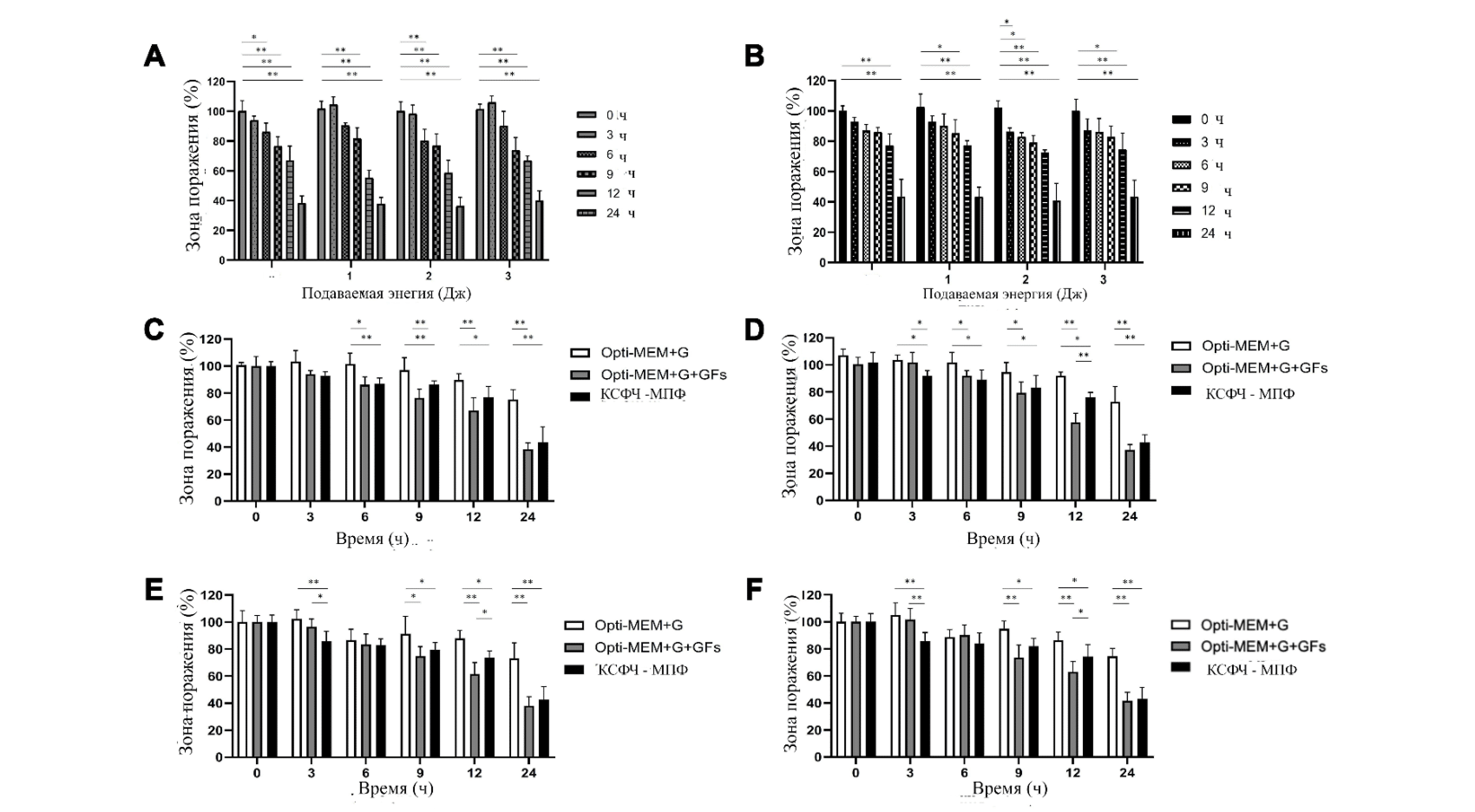
Рис. 4 Анализ ранозаживляющих свойств ДФЧ, обработанных плазмой и культивированных в КСФЧ-МПФ. ДФЧ были обработаны азотной плазмой с последующей культивацией в (A) Opti-MEM+G+GFs и (B) КСФЧ-МПФ. Результаты были получены через 0, 3, 6, 9, 12 и 24 ч после обработки азотной плазмой. После обработки проводился сравнительный анализ данных в группах культуральных сред Opti-MEM+G, Opti-MEM+G+GFs и КСФЧ-МПФ. Измерение зоны поражения (WA%) проводилось в каждый отрезок времени времени после © отсутствия обработки, (D) обработки при настройках подачи энергии в 1 Дж, (E) обработки при настройках подачи энергии в 2 Дж и (F) обработки при настройках подачи энергии в 3 Дж. *P < 0,05,**P < 0,001.
В культуре Opti-MEM+G+GF, WA% необработанных ДФЧ значительно снизился через 6, 9, 12 и 24 ч по сравнению с 0 ч (Рис. 4A и 5). WA% значительно снизился через 9, 12, и 24 ч по сравнению с 0 ч после обработки ДФЧ плазмой при настройке 1 Дж/импульс; через 6, 9, 12 и 24 ч после обработки ДФЧ плазмой при настройке 2 Дж/импульс; через 9, 12 и 24 ч после обработки ДФЧ плазмой при настройке 3 Дж/импульс. Статистических значимых изменений WA% при разных значениях подачи энергии не обнаружено ни на одном отрезке времени. В культуре КСФЧ-МПФ, WA% необработанных ДФЧ значительно снизился через 12 и 24 ч по сравнению с 0 ч (Рис. 4B и 6). WA% значительно снизился через 9, 12 и 24 ч по сравнению с 0 ч в ДФЧ, обработанных плазмой при настройке 1 Дж/импульс; через 3, 6, 9, 12 и 24 ч в ДФЧ, обработанных плазмой при настройке 2 Дж/импульс; через 9, 12 и 24 ч в ДФЧ, обработанных плазмой при настройке 3 Джи/импульс. Статистических значимых изменений WA% при разных значениях подачи энергии не обнаружено ни на одной отрезке времени. Снижение WA% необработанных ДФЧ было отмечено через 6 ч в Opti-MEM+G+GFs и КСФЧ-МПФ; через 9 ч в Opti-MEM+G+GFs; через 12 ч в Opti-MEM+G+GFs и КСФЧ-МПФ, через 24 ч в Opti-MEM+G+GFs и КСФЧ-МПФ по сравнению с культурой Opti-MEM+G (Рис. 4C). ДФЧ, обработанные при настройках подачи энергии в 1 Дж/импульс, продемонстрировали снижение WA% через 3 ч в КСФЧ-МПФ, через 6, 12 и 24 ч в Opti-MEM+G+GFs и КСФЧ-МПФ по сравнению с культурой Opti-MEM+G (Рис. 4D). ДФЧ, обработанные при настройках подачи энергии в 2 и 3 Дж/импульс, продемонстрировали снижение WA% через 3 ч в КСФЧ-МПФ, через 9, 12 и 24 ч в Opti-MEM+G+GFs и КСФЧ-МПФ по сравнению с культурой Opti-MEM+G (Рис. 4E и F, соответственно).
Рис. 5 Изображение исследования ранозаживляющих свойств. ДФЧ были обработаны азотной плазмой при настройках энергии в 1, 2 и 3 Дж с последующей культивацией в Opti-MEM+G+GFs. Снимки были сделаны микроскопом через 0, 3, 6, 9, 12 и 24 ч после обработки азотной плазмой. Неокрашенные клетки, исходное увеличение изображения в 4 раза.
Скорость миграции обработанных плазмой ДФЧ, культивированных в КСФЧ-МПФ
Оценка скорости миграции клеток была произведена после обработки ДФЧ азотной плазмой и инкубации в Opti-MEM+G+GFs и КСФЧ-МПФ на протяжении 24 ч. В Opti-MEM+G+GFs скорость миграции необработанных ДФЧ составила 0,0163 ± 0,266 мм/ч, обработанных при настройках подачи энергии в 1 Дж/импульс — 0,0171 ± 0,319 мм/ч, обработанных при настройках подачи энергии в 2 Дж/импульс — 0,0175 ± 0,49 мм/ч, обработанных при настройках подачи энергии в 3 Дж/импульс — 0,0165 ± 0,167 мм/ч. Статистически значимых изменений при разных значениях подачи энергии выявлено не было (P>0,05) (Рис. 7A). Однако в КСФЧ-МПФ скорость миграции необработанных ДФЧ составила 0,0202 ± 0,197 мм/ч, обработанных при настройках подачи энергии в 1 Дж/импульс — 0,0188 ± 0,204 мм/ч, обработанных при настройках подачи энергии в 2 Дж/импульс — 0,0191 ± 0,313 мм/ч, обработанных при настройках подачи энергии в 3 Дж/импульс — 0,0181 ± 0,157 мм/ч. Статистически значимых изменений при разных значениях подачи энергии выявлено не было (P > 0,05) (Рис. 7B). При сравнении влияния сред Opti-MEM+G, Opti-MEM+G+GFs, и КСФЧ-МПФ на скорость миграции обработанных плазмой ДФЧ, мы обнаружили, что контрольные необработанные плазмой ДФЧ и обработанные плазмой ДФЧ характеризовались наибольшей скоростью миграции при любых настройках подачи энергии в КСФЧ-МПФ, с более медленными показателями в Opti-MEM+G+GFs и наименьшей скоростью в Opti-MEM+G в рамках данного исследования (Рис. 7C-F).
05
Результаты и обсуждения
В рамках данного исследования мы обработали азотной плазмой ДФЧ, культивированные в Opti-MEM+G, с настройками подачи энергии в 1, 2 и 3 Дж/импульс тремя последовательными импульсами и сравнили пролиферацию клеток и ранозаживляющие свойства через 0, 3, 6, 12 и 24 ч с этими же данными контрольной группы. Жизнеспособность ДФЧ, обработанных при настройке 1 Дж/импульс, не снизилась ни в один отрезок времени времени по сравнению с контрольной группой. Жизнеспособность ДФЧ, обработанных при настройке 2 Дж/импульс, снизилась через 24 ч, а жизнеспособность ДФЧ, обработанных при настройке 3 Дж/импульс, снизилась через 12 и 24 ч. Отличия условий нашего эксперимента от условий других исследований заключались в следующем: 1) газообразный источник плазмы — азот, 2) азотная плазма поступала в ДФЧ струйно, давление импульса составило 10−12 бар, длительность импульса составляла миллисекунды, и 3) азотная плазма поступала непосредственно в ДФЧ, культивированные после обработки в Opti-MEM+G, Opti-MEM+G+GFs и КСФЧ-МПФ. Таким образом, мы предполагаем, что свойства жизнеспособности и пролиферации обработанных плазмой ДФЧ отражают результаты непосредственного воздействия плазмы, но не косвенного влияния обработанной плазмой среды на ДФЧ.
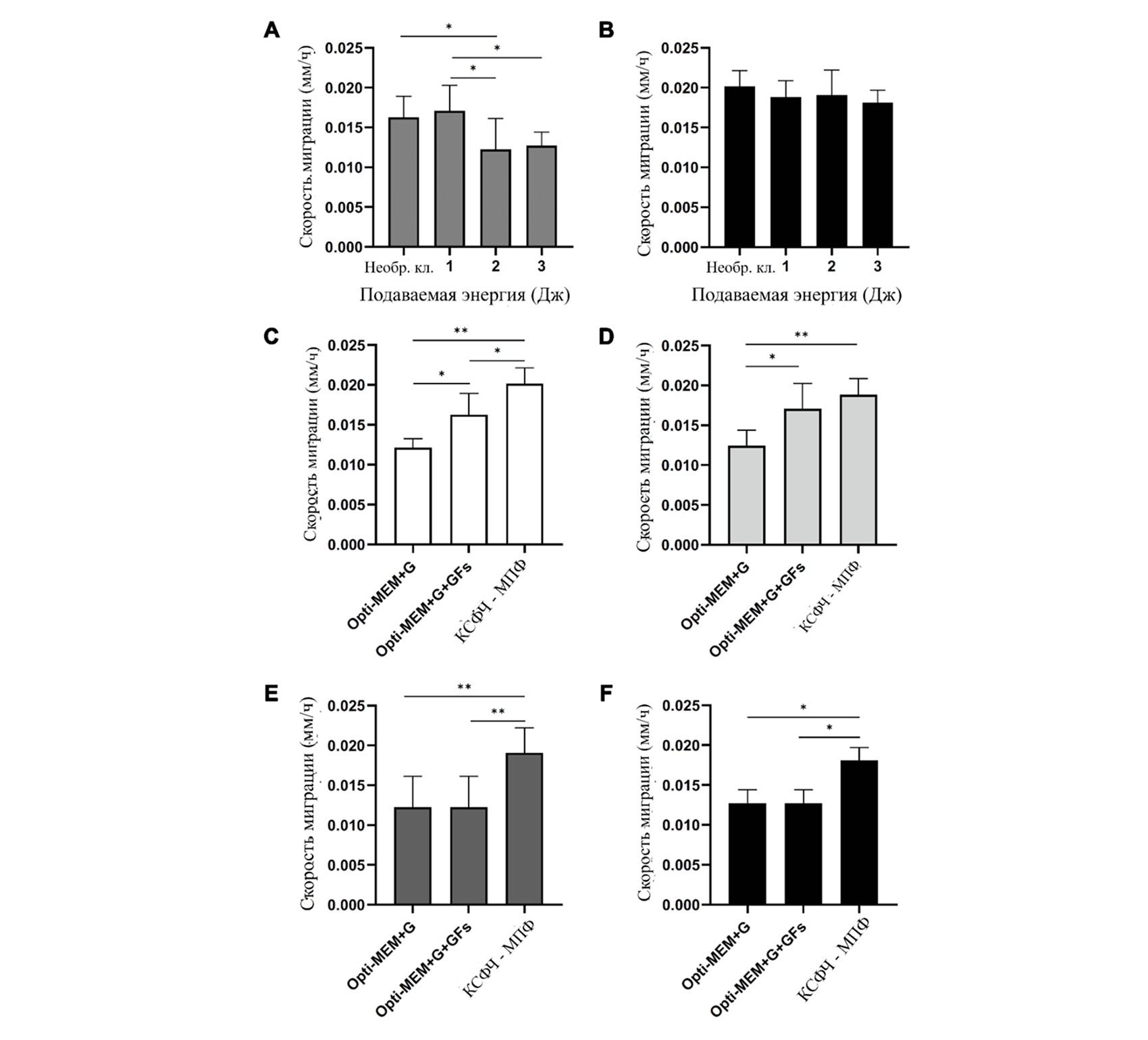
Рис. 7 Скорость миграции клеток после обработки азотной плазмой. ДФЧ были обработаны тремя последовательными импульсами азотной плазмы при настройках подачи энергии в 1, 2 и 3 Дж, среда каждой экспериментальной группы была заменена на (A) Opti-MEM+G+GFs и (B) КСФЧ-МПФ для последующей культивации. Сравнение скорости миграции проводилось в (A и B) группах с разными настройками подачи азотной плазмы и (C-F) группах культуральных сред после обработки, соответственно. © Контрольная группа, (D) обработка азотной плазмой при настройке подачи энергии в 1 Дж, (E) обработка азотной плазмой при настройке подачи энергии в 2 Дж, (F) обработка азотной плазмой при настройке подачи энергии в 3 Дж. *P <0,05, **P <0,001.
Среда Opti-MEM имела более низкий уровень сыворотки и более высокие уровни гипоксантина и тимидина по сравнению с другими культуральными средами. Мы использовали Opti-MEM без добавления эмбриональной телячьей сыворотки для обеспечения выработки МПФ фибробластами человека в КСФЧ с отсутствием или низким содержанием сывороточных белков.
Несмотря на то, что в Opti-MEM был добавлен синтетический эпидермальный фактор роста и фактор роста фибробластов человека, мы считаем, что фибробласты использовали большинство добавленных факторов роста для стимуляции секреции МПФ.
Предыдущее исследование ряда факторов роста G1 показали, что при приготовлении КСФЧ-МПФ использовалось значительно большее число и количество факторов роста по сравнению с контрольной средой.16 Кроме того, клетки внешней корневой оболочки (ВКО), обработанные КСФЧ-МПФ, вырабатывали большее число факторов роста по сравнению с клеткам ВКО, обработанных контрольной средой.
В настоящем исследовании культуральные среды, включая Opti-MEM+G, Opti-MEM+G+GFs и КСФЧ-МПФ, использовались для культивации обработанных плазмой и необработанных ДФЧ. Общая жизнеспособность ДФЧ в КСФЧ-МПФ в различных экспериментальных условиях была значительно выше, чем жизнеспособность ДФЧ, культивированных в Opti-MEM+G, и примерно такой же как жизнеспособность ДФЧ, культивированных в Opti-MEM+G+GF. Таким образом, мы полагаем, что культивация в КСФЧ-МПФ может повысить жизнеспособность ДФЧ после обработки плазмой с низко- и высокоэнергетическими параметрами. Кроме того, результаты нашего исследования показали, что применение КСФЧ-МПФ вызвало раннее снижение WA% через 3 ч и большее снижение через 12 и 24 ч. Также ДФЧ в КСФЧ-МПФ продемонстрировали более высокую скорость миграции по сравнению с ДФЧ в Opti-MEM+G и Opti-MEM+G+GFs. Однако необходимо дальнейшее подтверждение, является ли КСФЧ-МПФ механизмом защиты ДФЧ от апоптоза, вызванного обработкой высокоэнергетической плазмой, или фактором стимуляции пролиферации ДФЧ. Кроме того, необходимо дальнейшее изучение механизмов действия МПФ, за исключением эпидермального фактора роста и фактора роста фибробластов, в процессе заживления раны с целью определения эффективности и безопасности применения МПФ в КСФЧ и добавления синтетических факторов роста в культуральные среды.
Предыдущий in vivo эксперимент на крысах показал, что обработка азотной плазмой приводит к пролиферации дермальных фибробластов и неоколлагенезу. Азотная плазма содержит оксид азота (NO), NO2, активные формы кислорода (АФК), и активные формы азота (АФА). NO играет важную роль в пролиферации кератиноцитов и фибробластов. АФК и АФА способствуют заживлению раны, повышая активность ядерного фактора, родственного эритроидному фактору-2/Kelch-подобному ЕСН-ассоциированного белка-1/BTB-домена белка BACH-1. В то же время, обработка аргоновой плазмой стимулирует пролиферацию фибробластов у крыс, повышает внутриклеточные уровни содержания NO, АФК, и O2, активирует транскрипционный фактор NF-κB, и повышает уровень экспрессии циклина D1. Кроме того, непрямая обработка аргоновой плазмой увеличивает пролиферацию и миграцию кератиноцитов линии HaCaT или фибробластов линии MRC5, способствуя закрытию ран.
На основании полученных нами результатов, мы рекомендуем применять комбинированную обработку низко- и высокоэнергетической плазмой и КСФЧ-МПФ. Как сообщается, лечение низкоэнергетической плазмой удаляет мелазмы, плохо поддающиеся лечению, у пациентов азиатского происхождения, а патогенез мелазмы в значительной степени связан с факторами выработки «увядающих» ДФЧ.
Мы предполагаем, что сочетание низкоэнергетической плазмы и КСФЧ-МПФ теоретически способствует омоложению увядающих ДФЧ и участков дермы, поврежденных ультрафиолетом, а также, что МПФ, полученные из молодых ДФЧ, могут противодействовать патологическому воздействию факторов выработки увядающих ДФЧ. Высокоэнергетическая азотная плазма используется для лечения фотостарения кожи, однако, необходимое на реабилитацию время и поствоспалительная гиперпигментация значительным образом ограничивают применение высокоэнергетических режимов на пациентах азиатского происхождения.
Мы полагаем, что применение КСФЧ-МПФ до и после плазмотерапии может предотвратить чрезмерное повреждение тканей и риск возникновения побочных эффектов, связанных с лечением высокоэнергетической плазмой, а также способствовать заживлению ран для достижения лучших клинических результатов. Однако требуется проведение дальнейших контролируемых клинических исследований для подтверждения данных результатов и определения оптимальных режимов лечения.
Несмотря на то, что в Opti-MEM был добавлен синтетический эпидермальный фактор роста и фактор роста фибробластов человека, мы считаем, что фибробласты использовали большинство добавленных факторов роста для стимуляции секреции МПФ.
Предыдущее исследование ряда факторов роста G1 показали, что при приготовлении КСФЧ-МПФ использовалось значительно большее число и количество факторов роста по сравнению с контрольной средой.16 Кроме того, клетки внешней корневой оболочки (ВКО), обработанные КСФЧ-МПФ, вырабатывали большее число факторов роста по сравнению с клеткам ВКО, обработанных контрольной средой.
В настоящем исследовании культуральные среды, включая Opti-MEM+G, Opti-MEM+G+GFs и КСФЧ-МПФ, использовались для культивации обработанных плазмой и необработанных ДФЧ. Общая жизнеспособность ДФЧ в КСФЧ-МПФ в различных экспериментальных условиях была значительно выше, чем жизнеспособность ДФЧ, культивированных в Opti-MEM+G, и примерно такой же как жизнеспособность ДФЧ, культивированных в Opti-MEM+G+GF. Таким образом, мы полагаем, что культивация в КСФЧ-МПФ может повысить жизнеспособность ДФЧ после обработки плазмой с низко- и высокоэнергетическими параметрами. Кроме того, результаты нашего исследования показали, что применение КСФЧ-МПФ вызвало раннее снижение WA% через 3 ч и большее снижение через 12 и 24 ч. Также ДФЧ в КСФЧ-МПФ продемонстрировали более высокую скорость миграции по сравнению с ДФЧ в Opti-MEM+G и Opti-MEM+G+GFs. Однако необходимо дальнейшее подтверждение, является ли КСФЧ-МПФ механизмом защиты ДФЧ от апоптоза, вызванного обработкой высокоэнергетической плазмой, или фактором стимуляции пролиферации ДФЧ. Кроме того, необходимо дальнейшее изучение механизмов действия МПФ, за исключением эпидермального фактора роста и фактора роста фибробластов, в процессе заживления раны с целью определения эффективности и безопасности применения МПФ в КСФЧ и добавления синтетических факторов роста в культуральные среды.
Предыдущий in vivo эксперимент на крысах показал, что обработка азотной плазмой приводит к пролиферации дермальных фибробластов и неоколлагенезу. Азотная плазма содержит оксид азота (NO), NO2, активные формы кислорода (АФК), и активные формы азота (АФА). NO играет важную роль в пролиферации кератиноцитов и фибробластов. АФК и АФА способствуют заживлению раны, повышая активность ядерного фактора, родственного эритроидному фактору-2/Kelch-подобному ЕСН-ассоциированного белка-1/BTB-домена белка BACH-1. В то же время, обработка аргоновой плазмой стимулирует пролиферацию фибробластов у крыс, повышает внутриклеточные уровни содержания NO, АФК, и O2, активирует транскрипционный фактор NF-κB, и повышает уровень экспрессии циклина D1. Кроме того, непрямая обработка аргоновой плазмой увеличивает пролиферацию и миграцию кератиноцитов линии HaCaT или фибробластов линии MRC5, способствуя закрытию ран.
На основании полученных нами результатов, мы рекомендуем применять комбинированную обработку низко- и высокоэнергетической плазмой и КСФЧ-МПФ. Как сообщается, лечение низкоэнергетической плазмой удаляет мелазмы, плохо поддающиеся лечению, у пациентов азиатского происхождения, а патогенез мелазмы в значительной степени связан с факторами выработки «увядающих» ДФЧ.
Мы предполагаем, что сочетание низкоэнергетической плазмы и КСФЧ-МПФ теоретически способствует омоложению увядающих ДФЧ и участков дермы, поврежденных ультрафиолетом, а также, что МПФ, полученные из молодых ДФЧ, могут противодействовать патологическому воздействию факторов выработки увядающих ДФЧ. Высокоэнергетическая азотная плазма используется для лечения фотостарения кожи, однако, необходимое на реабилитацию время и поствоспалительная гиперпигментация значительным образом ограничивают применение высокоэнергетических режимов на пациентах азиатского происхождения.
Мы полагаем, что применение КСФЧ-МПФ до и после плазмотерапии может предотвратить чрезмерное повреждение тканей и риск возникновения побочных эффектов, связанных с лечением высокоэнергетической плазмой, а также способствовать заживлению ран для достижения лучших клинических результатов. Однако требуется проведение дальнейших контролируемых клинических исследований для подтверждения данных результатов и определения оптимальных режимов лечения.
06
Выводы
Результаты нашего исследования показали, что лечение низкоэнергетической нетермической азотной плазмой атмосферного давления улучшает пролиферацию ДФЧ и заживление ран. Жизнеспособность и ранозаживляющие свойства необработанных ДФЧ улучшились после обработки культурой КСФЧ-МПФ. Кроме того, при культивации ДФЧ, обработанных низкоэнергетической плазмой с КСФЧ-МПФ, улучшились жизнеспособность и ранозаживляющие свойства клеток. Обработка высокоэнергетической азотной плазмой снижала жизнеспособность ДФЧ и замедляла заживление ран, однако после обработки плазмой культура с КСФЧ-МПФ существенно восстанавливала эти свойства. Однако требуется проведение дальнейших исследований для изучения механизмов пролиферации, улучшенной под воздействием плазмы, и КСФЧ-МПФ-индуцированного ускорения заживления ран.
07
Список литературы
Лоулор К. Т., Каур П., Дермальный вклад в строение и самообновление межфолликулярного эпидермиса человека.
Лири Т., Джонс П. Л., Эпплби М., Блайт А., Паркинсон К., Стэнли М., Самообновление эпидермальных кератиноцитов в зависимости от целостности дермы.
Туан Т.Л., Келлер Л. К., Сан Д., Нимни М. Е., Чунг Д., Активация роста кератиноцитов дермальными фибробластами на коллагеновых гелях.
Соррелл Дж. М., Бабер М. А., Каплан А. И., Различия сопоставленных по участку папиллярных и ретикулярных дермальных фибробластов человека по выделению специфических факторов роста/цитокинов и взаимодействию с кератиноцитами.
Мааорф М., Локанатан Й., Рузимах Х. И, Саим А, Чаудхури С. Р., Протеомный анализ кондиционированной среды дермальных фибробластов человека (КСФЧ).
Кубо К., Куроянаги Й. Исследование цитокинов, выделяемых фибробластами в культивируемом дермальном заменителе.
Чаудхури С. Р., Аминуддин Б. С., Рузимах Б. Х., Влияние добавок к кондиционированной среде дермальных фибробластов на экспансию кератиноцитов за счет усиления адгезии.
Манира M., Чаудхури С. Р., Рослиза A., др., Концентрационно-зависимое влияние кондиционированной среды дермальных фибробластов на ранозаживляющие свойства кератиноцитов in vitro.
Ким Х., Ким Х. Дж., Ким Х. K., Хонг Дж. Й., Чо С. Б, Воздействие импульсов аргоновой и азотной плазмы на кожу и кожные придатки наживотной модели in vivo.
Элсаи М. Л., Каммер Дж. Н., Оценка технологии плазменной регенерации кожи для ремоделирования кожи.
Фицпатрик Р., Бернштейн Е., Айер С., Браун Д., Эндрюс П., Пенни К., Гистопатологическая оценка системы плазменной регенерациикожи (PSR) в сравнении со стандартным углекислотным лазером для шлифовки кожи на животной модели.
Сандесон А. Р., Ву Э. Ч., Ляу Л. Х., Гарг Р., Гангнес Р. А., Влияние увлажнения местным анестетиком на глубину термического повреждения от устройства плазменной регенерации кожи.
Суарес-Арнедо А., Фигероа Ф. Т., Клавихо К., Арбелаес П., Круз Х. К., Каролина М-К., Плагин image J для высокопроизводительного анализа изображений при оценке заживления ран in vitro. PLoS One.
Града А., Отеро-Винас М., Прието-Кастрильо Ф., Обаги З., Фаланга В., Методы исследования стали проще: анализ коллективной миграции клеток с использованием анализа заживления ран.
Ху Р., Цао Ц., Сунь Д., Чен Дж., Чжэн Ц., Сяо Ф., Новый метод нейронной дифференцировки клеток PC12 с использованием Opti-MEM в качестве базовой индукционной среды.
Шин Дж. М., Ли Ю. Ю., Ким К. М. и др., Потенциальная роль мультипептидных факторов, полученных из фибробластов, в активации факторов роста и β-катенина в клетках волосяных фолликулов.
Бабоссалам С., Абдоллахимадж Ф., Агиги М. и др., Влияние азотной плазмы на кожу и волосяные фолликулы: возможное перспективное будущее лечения алопеции.
Калс-Гриерсон М.М., Ормерод А., Функция оксида азота в коже. Оксид азота.
Шмидт А., Дитрих С., Стойер А. и др. Активация нетермической плазмой кератиноцитов человека путем стимуляции антиоксидантов и путей фазы II.
Лю Дж.Р., Сюй Г. М., Ши К. М., Чжан Г. Дж., Низкотемпературная плазма способствует пролиферации фибробластов путем активации пути NF-κB и увеличения экспрессии циклина D1.
Шмидт А., Бекешус С., Венде К., Фоллмар Б., фон Вёдтке Т., Струя холодной плазмы ускоряет заживление полнослойных кожных ран на мышиных моделях.
Ким Х., Ким Х., Ким Ю. К., Чо С. Б., Лечение рефрактерной мелазмы нетермической азотной плазмой атмосферного давления, генерируемой микроволновым излучением.
Ким М., Ким С. М., Квон С., Пак ТиДжей, Кан Х. И., Увядающие фибробласты в патофизиологии мелазмы.
Юн Дж.Э., Ким Й., Квон С. и др., Увядающие фибробласты вызывают возрастную пигментацию: потенциальная терапевтическая мишень для лечения возрастного лентиго. Тераностика.
Авторы
Сонг И Ли
До Ён Ким
Санг Бом Сух
Чжи Юн Су
Сунг Бин Чо
Лири Т., Джонс П. Л., Эпплби М., Блайт А., Паркинсон К., Стэнли М., Самообновление эпидермальных кератиноцитов в зависимости от целостности дермы.
Туан Т.Л., Келлер Л. К., Сан Д., Нимни М. Е., Чунг Д., Активация роста кератиноцитов дермальными фибробластами на коллагеновых гелях.
Соррелл Дж. М., Бабер М. А., Каплан А. И., Различия сопоставленных по участку папиллярных и ретикулярных дермальных фибробластов человека по выделению специфических факторов роста/цитокинов и взаимодействию с кератиноцитами.
Мааорф М., Локанатан Й., Рузимах Х. И, Саим А, Чаудхури С. Р., Протеомный анализ кондиционированной среды дермальных фибробластов человека (КСФЧ).
Кубо К., Куроянаги Й. Исследование цитокинов, выделяемых фибробластами в культивируемом дермальном заменителе.
Чаудхури С. Р., Аминуддин Б. С., Рузимах Б. Х., Влияние добавок к кондиционированной среде дермальных фибробластов на экспансию кератиноцитов за счет усиления адгезии.
Манира M., Чаудхури С. Р., Рослиза A., др., Концентрационно-зависимое влияние кондиционированной среды дермальных фибробластов на ранозаживляющие свойства кератиноцитов in vitro.
Ким Х., Ким Х. Дж., Ким Х. K., Хонг Дж. Й., Чо С. Б, Воздействие импульсов аргоновой и азотной плазмы на кожу и кожные придатки наживотной модели in vivo.
Элсаи М. Л., Каммер Дж. Н., Оценка технологии плазменной регенерации кожи для ремоделирования кожи.
Фицпатрик Р., Бернштейн Е., Айер С., Браун Д., Эндрюс П., Пенни К., Гистопатологическая оценка системы плазменной регенерациикожи (PSR) в сравнении со стандартным углекислотным лазером для шлифовки кожи на животной модели.
Сандесон А. Р., Ву Э. Ч., Ляу Л. Х., Гарг Р., Гангнес Р. А., Влияние увлажнения местным анестетиком на глубину термического повреждения от устройства плазменной регенерации кожи.
Суарес-Арнедо А., Фигероа Ф. Т., Клавихо К., Арбелаес П., Круз Х. К., Каролина М-К., Плагин image J для высокопроизводительного анализа изображений при оценке заживления ран in vitro. PLoS One.
Града А., Отеро-Винас М., Прието-Кастрильо Ф., Обаги З., Фаланга В., Методы исследования стали проще: анализ коллективной миграции клеток с использованием анализа заживления ран.
Ху Р., Цао Ц., Сунь Д., Чен Дж., Чжэн Ц., Сяо Ф., Новый метод нейронной дифференцировки клеток PC12 с использованием Opti-MEM в качестве базовой индукционной среды.
Шин Дж. М., Ли Ю. Ю., Ким К. М. и др., Потенциальная роль мультипептидных факторов, полученных из фибробластов, в активации факторов роста и β-катенина в клетках волосяных фолликулов.
Бабоссалам С., Абдоллахимадж Ф., Агиги М. и др., Влияние азотной плазмы на кожу и волосяные фолликулы: возможное перспективное будущее лечения алопеции.
Калс-Гриерсон М.М., Ормерод А., Функция оксида азота в коже. Оксид азота.
Шмидт А., Дитрих С., Стойер А. и др. Активация нетермической плазмой кератиноцитов человека путем стимуляции антиоксидантов и путей фазы II.
Лю Дж.Р., Сюй Г. М., Ши К. М., Чжан Г. Дж., Низкотемпературная плазма способствует пролиферации фибробластов путем активации пути NF-κB и увеличения экспрессии циклина D1.
Шмидт А., Бекешус С., Венде К., Фоллмар Б., фон Вёдтке Т., Струя холодной плазмы ускоряет заживление полнослойных кожных ран на мышиных моделях.
Ким Х., Ким Х., Ким Ю. К., Чо С. Б., Лечение рефрактерной мелазмы нетермической азотной плазмой атмосферного давления, генерируемой микроволновым излучением.
Ким М., Ким С. М., Квон С., Пак ТиДжей, Кан Х. И., Увядающие фибробласты в патофизиологии мелазмы.
Юн Дж.Э., Ким Й., Квон С. и др., Увядающие фибробласты вызывают возрастную пигментацию: потенциальная терапевтическая мишень для лечения возрастного лентиго. Тераностика.
Авторы
Сонг И Ли
До Ён Ким
Санг Бом Сух
Чжи Юн Су
Сунг Бин Чо
Читайте статьи:
30 Июня 2024
Новые технологии красоты


30 Июня 2024
Новые технологии красоты


30 Июня 2024
Новые технологии красоты


Все статьи из блога
Все статьи из блога









