

Оставить заявку
Оставить заявку

ОСТАВИТЬ ЗАЯВКУ
Заполняя данную форму, вы соглашаетесь с Правилами обработки персональных данных
Воздействие импульсов аргоновой и азотной плазмы на кожу в рамках клинического исследования на животных моделях
19 Августа 2025
Новые технологии красоты


01
Аннотация
Предпосылки: Для использования в медицинских целях плазма генерируется в аппарате из инертного газообразного источника посредством ультравысокочастотных генераторов и подается в таргетированную ткань в виде импульсов с длительностью, выраженной в миллисекундах.
Цель: оценить реакции в тканях кожи и кожных придатках на стимуляцию импульсами аргоновой или азотной плазмы в лабораторных условиях на животной модели.
Методы: Импульсы аргоновой и азотной плазмы с различными настройками неинвазивно подаются в кожу крысы в лабораторных условиях. Образцы проходят гистологическую оценку после окраски гематоксилином и эозином и трихромного окрашивания по Массону.
Результаты: При низкоэнергетических настройках в 1.0, 1.5 и 2.0 Дж процедуры с азотной плазмой образовывалась заметная коагуляция тканей на глубине 31.5 ± 8.3, 94.9 ± 16.9 и 171.6 ± 19.7 мкм, соответственно, в День 0. При высокоэнергетических настройках в 2.5 и 3.0 Дж процедуры с азотной плазмой создавали визуально заметную коагуляцию тканей на глубине 381.7 ± 33.6 мкм и 456.3 ± 75.7 мкм, соответственно, в День 0.
Заключение: Процедуры с аргоновой плазмой стимулируют микроскопические изменения в эпидермисе, дерме и сальных железах без излишнего термического повреждения, в то время как процедуры с азотной плазмой вызывают энергетически зависимую термическую коагуляцию в эпидермисе и дерме с заметным неоколлагенезом.
Цель: оценить реакции в тканях кожи и кожных придатках на стимуляцию импульсами аргоновой или азотной плазмы в лабораторных условиях на животной модели.
Методы: Импульсы аргоновой и азотной плазмы с различными настройками неинвазивно подаются в кожу крысы в лабораторных условиях. Образцы проходят гистологическую оценку после окраски гематоксилином и эозином и трихромного окрашивания по Массону.
Результаты: При низкоэнергетических настройках в 1.0, 1.5 и 2.0 Дж процедуры с азотной плазмой образовывалась заметная коагуляция тканей на глубине 31.5 ± 8.3, 94.9 ± 16.9 и 171.6 ± 19.7 мкм, соответственно, в День 0. При высокоэнергетических настройках в 2.5 и 3.0 Дж процедуры с азотной плазмой создавали визуально заметную коагуляцию тканей на глубине 381.7 ± 33.6 мкм и 456.3 ± 75.7 мкм, соответственно, в День 0.
Заключение: Процедуры с аргоновой плазмой стимулируют микроскопические изменения в эпидермисе, дерме и сальных железах без излишнего термического повреждения, в то время как процедуры с азотной плазмой вызывают энергетически зависимую термическую коагуляцию в эпидермисе и дерме с заметным неоколлагенезом.
02
Введение
Четвертое состояние материи — плазма, в основном, состоит из заряженных электронов и ионов. Для различных видов использования в медицине плазма может генерироваться из различных газообразных источников посредством вычленения электронов из атомов, используя ультравысокочастотные генераторы, функционирующие на основе радиочастоты и микроволн. В рамках подобных процедур плазма подается на таргетированные ткани при длине импульса в несколько миллисекунд. Среди газообразных источников азот, являясь инертной двухатомной молекулой, широко используется для производства плазмы. Возбужденный ионизированный азот неинвазивным предсказуемым образом передает энергию в кожу: азотная плазма создает хромофорнезависимое, точно контролируемое термическое повреждение и состояние для стимулирования ремоделирования коллагена в дерме.
Азотная плазма передает энергию, которая генерирует две отдельные зоны термического повреждения и модификации. В центральной зоне термического повреждения повреждение клетки необратимо и уходит вглубь от эпидермиса к дермо-эпидеральному соединению и верхним слоям дермы, в зависимости от настроек энергии импульса. Тем временем в периферийной зоне термической модификации, которая происходит рядом с центральной зоной термического повреждения, реакция ткани на стимулирование азотной плазмой обратима. Следовательно, азотная плазма используется в медицинских целях для лечения фотоповреждений кожи со смешанной пигментацией повреждений и морщин благодаря возможности настройки энергии импульса под данные пациента.
Помимо азотной плазмы, аргоновая плазма используется для решения многих медицинских задач ввиду своих антибактериальных, антивирусных, противогрибковых и противозудных свойств. Механизм антибактериального эффекта от аргоновой плазмы представляется следующим образом: происходит лизис микроорганизмов ввиду аккумуляции заряженных частиц и прямого или оксидативного повреждения мембран цитоплазмы, бактериального белка и ДНК. Процедуры с низкотемпературной аргоновой плазмой показали свою эффективность в лечении ран в хронической и острой форме. Низкотемпературная аргоновая плазма стимулирует процессы заживления ран, активируя нуклеарный фактор транскрипции κB, повышая экспрессию циклина D1, стимулируя пролиферацию фибробластов .
В данном описательном наблюдении — исследовании нашей целью было оценить реакцию тканей кожи и кожных придатков на импульсы аргоновой и азотной плазмы в лабораторных условиях на животной модели. Мы сравнили немедленную и отложенную реакцию тканей в ответ на передачу импульсов плазмы из различных газообразных источников и при различных настройках импульсов энергии. Аргоновая и азотная плазмы были созданы с использованием ультравысокочастотных микроволновых генераторов и переданы в кожу крысы в лабораторных условиях. Затем, образцы кожи, взятые в разное время, прошли гистологический анализ после окраски гематоксилином и эозином и трихромного окрашивания по Массону.
Азотная плазма передает энергию, которая генерирует две отдельные зоны термического повреждения и модификации. В центральной зоне термического повреждения повреждение клетки необратимо и уходит вглубь от эпидермиса к дермо-эпидеральному соединению и верхним слоям дермы, в зависимости от настроек энергии импульса. Тем временем в периферийной зоне термической модификации, которая происходит рядом с центральной зоной термического повреждения, реакция ткани на стимулирование азотной плазмой обратима. Следовательно, азотная плазма используется в медицинских целях для лечения фотоповреждений кожи со смешанной пигментацией повреждений и морщин благодаря возможности настройки энергии импульса под данные пациента.
Помимо азотной плазмы, аргоновая плазма используется для решения многих медицинских задач ввиду своих антибактериальных, антивирусных, противогрибковых и противозудных свойств. Механизм антибактериального эффекта от аргоновой плазмы представляется следующим образом: происходит лизис микроорганизмов ввиду аккумуляции заряженных частиц и прямого или оксидативного повреждения мембран цитоплазмы, бактериального белка и ДНК. Процедуры с низкотемпературной аргоновой плазмой показали свою эффективность в лечении ран в хронической и острой форме. Низкотемпературная аргоновая плазма стимулирует процессы заживления ран, активируя нуклеарный фактор транскрипции κB, повышая экспрессию циклина D1, стимулируя пролиферацию фибробластов .
В данном описательном наблюдении — исследовании нашей целью было оценить реакцию тканей кожи и кожных придатков на импульсы аргоновой и азотной плазмы в лабораторных условиях на животной модели. Мы сравнили немедленную и отложенную реакцию тканей в ответ на передачу импульсов плазмы из различных газообразных источников и при различных настройках импульсов энергии. Аргоновая и азотная плазмы были созданы с использованием ультравысокочастотных микроволновых генераторов и переданы в кожу крысы в лабораторных условиях. Затем, образцы кожи, взятые в разное время, прошли гистологический анализ после окраски гематоксилином и эозином и трихромного окрашивания по Массону.
03
Методы
В данном исследовании генератор плазмы (PLADUOTM; ООО «Шенб Ко. Лтд» (Shenb Co., Ltd.), г. Сеул, Южная Корея) генерирует плазму из газообразного источника: аргона и азота, и доставляет импульсы в кожу. Каждая из плазм, аргоновая и азотная, была подготовлена после загрузки 0.12−0.67 мл аргона/импульс и 0.20−1.42 мл азота/импульс, соответственно, в зависимости от настроек энергии. Мы использовали микроволновой генератор с частотой 2.45 ГГц для производства энергии импульса от 0.25 до 1.3 Дж с шагом в 0.05−0.15 Дж для генерации аргоновой плазмы и диапазона энергии на импульс от 0.5 до 4 Дж с шагом в 0.25 Дж для генерации азотной плазмы.
Диаметр сопла был равен 5 мм, расстояние между кончиком сопла и кожей регулировалось и было равно 5, 10 или 15 мм. После загрузки инертного аргона и азота, газ конвертировался в возбужденный ионизированный газ посредством микроволновой энергии в сопле в дальнем конце манипулы. Длительность импульса для передачи плазмы в кожу была равна 3−17 мсек для аргоновой плазмы и 5−36 мсек для азотной плазмы.
Диаметр сопла был равен 5 мм, расстояние между кончиком сопла и кожей регулировалось и было равно 5, 10 или 15 мм. После загрузки инертного аргона и азота, газ конвертировался в возбужденный ионизированный газ посредством микроволновой энергии в сопле в дальнем конце манипулы. Длительность импульса для передачи плазмы в кожу была равна 3−17 мсек для аргоновой плазмы и 5−36 мсек для азотной плазмы.
Генерация импульсов аргоновой и азотной плазмы
Процедура использования аргоновой и азотной плазмы на коже крысы
Все протоколы эксперимента прошли оценку комитета по этике Сунчунангского университета институциональной защиты и использования животных. Все использованные методы были проведены в соответствии с релевантными руководствами и правилами.
Девять крыс аутбредной линии Спраг-Доули мужского пола были закуплены (Orient Bio Corp. («Ориент Био Копр.»), г. Соннам, Южная Корея) в возрасте 6 недель. Лабораторные эксперименты проводились, когда крысы достигли возраста 14 недель и веса 450−500 гр. После аккуратного удаления волосяного покрова на спине крысы, кожа была обработана 70% спиртом. Затем, на коже была проведена разметка черными чернилами, чтобы можно было определить, импульс с какой мощностью был применен в каждой отдельной зоне (каждый участок имел диаметр в 1 см; каждая крыса на спине имела 18 участков; общее количество участков на спинах крыс — 162). Каждый участок располагался как минимум в 0.5 см от других участков с целью минимизации реакции тканей на стимуляцию плазмой на соседних участках.
Одно прохождение аргоновой и, отдельно, азотной плазмой было проведено на в каждом участке на расстоянии 5 мм до кожи без повторного попадания импульса на уже обработанный участок. Настройки энергии были следующими для аргоновой плазмы: 0.25, 0.35, 0.45, 0.6, 0.75, 0.85, 1.1 и 1.3 Дж, а для азотной: 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5 и 4.0 Дж. Затем, пять прохождения аргоновой и, отдельно, азотной плазмой были проведены на индивидуальных участках на расстоянии 5 мм без повторного попадания импульса на уже обработанный участок. Настройки энергии были следующими для аргоновой плазмы: 0.35, 0.45, 0.6, 0.75, 0.85 Дж, а для азотной: 1.0, 1.5, 2.0, 2.5 и 3.0 Дж. И, наконец, 15 прохождений аргоновой и, отдельно, азотной плазмой были проведены на индивидуальных участках на расстоянии в 5 мм без повторного попадания импульса на уже обработанный участок. Настройки энергии были следующими для аргоновой плазмы: 0.45, 0.8 и 1.3 Дж, а для азотной: 1.5, 2.75 и 4.0 Дж. Каждый отдельный тест был проведен на трех крысах.
Девять крыс аутбредной линии Спраг-Доули мужского пола были закуплены (Orient Bio Corp. («Ориент Био Копр.»), г. Соннам, Южная Корея) в возрасте 6 недель. Лабораторные эксперименты проводились, когда крысы достигли возраста 14 недель и веса 450−500 гр. После аккуратного удаления волосяного покрова на спине крысы, кожа была обработана 70% спиртом. Затем, на коже была проведена разметка черными чернилами, чтобы можно было определить, импульс с какой мощностью был применен в каждой отдельной зоне (каждый участок имел диаметр в 1 см; каждая крыса на спине имела 18 участков; общее количество участков на спинах крыс — 162). Каждый участок располагался как минимум в 0.5 см от других участков с целью минимизации реакции тканей на стимуляцию плазмой на соседних участках.
Одно прохождение аргоновой и, отдельно, азотной плазмой было проведено на в каждом участке на расстоянии 5 мм до кожи без повторного попадания импульса на уже обработанный участок. Настройки энергии были следующими для аргоновой плазмы: 0.25, 0.35, 0.45, 0.6, 0.75, 0.85, 1.1 и 1.3 Дж, а для азотной: 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5 и 4.0 Дж. Затем, пять прохождения аргоновой и, отдельно, азотной плазмой были проведены на индивидуальных участках на расстоянии 5 мм без повторного попадания импульса на уже обработанный участок. Настройки энергии были следующими для аргоновой плазмы: 0.35, 0.45, 0.6, 0.75, 0.85 Дж, а для азотной: 1.0, 1.5, 2.0, 2.5 и 3.0 Дж. И, наконец, 15 прохождений аргоновой и, отдельно, азотной плазмой были проведены на индивидуальных участках на расстоянии в 5 мм без повторного попадания импульса на уже обработанный участок. Настройки энергии были следующими для аргоновой плазмы: 0.45, 0.8 и 1.3 Дж, а для азотной: 1.5, 2.75 и 4.0 Дж. Каждый отдельный тест был проведен на трех крысах.
Гистологический анализ
Крысы, принимавшие участие в эксперименте, были умерщвлены по стандартному протоколу для забора кусочков кожи в тех участках, на которые было оказано воздействие. Сразу же и на День 1, 5, 7, и 21 после процедур полнослойные образцы тканей, включая эпидермис, дерму, подкожный жир, мышцу и оболочку мышцы были получены для микроскопического исследования. Каждый образец был обработан в 10% буферном формалине и погружен между слоями парафина. Затем, серии срезов ткани толщиной в 4 мкм с каждого обработанного участка были подготовлены и окрашены гематоксилином и эозином, а также прошли трихромное окрашивание по Массону. Максимальная глубина немедленной и замедленной реакций тканей на воздействие плазмой была измерена с самых верхних слоев эпидермиса, за исключением рогового слоя эпидермиса, до самой глубинной коагуляции кожных тканей, используя программный пакет Image J («Имедж Дж») (версия 1.48, Национальные институты здоровья, штат Мэриленд, США). Значения представлены в виде среднего значения ± стандартное отклонение, за исключением случаев, когда указано иное значение.
04
Результаты
Аллергическая реакция тканей немедленного типа на воздействие аргоновой плазмой
Спектры испускания отдельных импульсов плазмы были замерены спектрометром (HR2000 +CG; «Оушеэн Оптикс» (Ocean Optics), г. Дунедин, штат Флорида, США). Аргоновая плазма продемонстрировала пики спектра на длине волны в 386.9, 388.2, 513.2, 515.9, 696.1, 737.8, 750.6, 751.0, 762.9, 771.7, 794.6, 800.7, 811.3, 826.1, 840.5, 842.3 и 912.2 нм (Изоб. 1A). Одно прохождение аргоновой плазмой с выстроенной настройкой энергии в 0.25 Дж не вызвало заметных изменений в эпидермисе и дерме, кроме как средне заметных линий Лангера в дермо-эпидермальных соединениях (Изображение 2А). Между тем кожа крыс, которая была под воздействием одного прохождения аргоновой плазмой с выстроенной настройкой энергии в 0.35−1.3 Дж продемонстрировала термическую реакцию тканей эозинофильного типа во всем эпидермисе с и без заметных линий Лангера в дермо-эпидермальных соединениях. Отекание средней тяжести было отмечено в нижних слоях эпидермиса участков кожи, которые прошли процедуру с настройкой 0.35 Дж (Изображение 2В), и перинуклеарная вакуолизация с пикнотичными ядрами в нижних слоях эпидермиса была отмечена в участках под воздействием 0.45, 0.6, и 0.75 Дж (Изображение 2В).
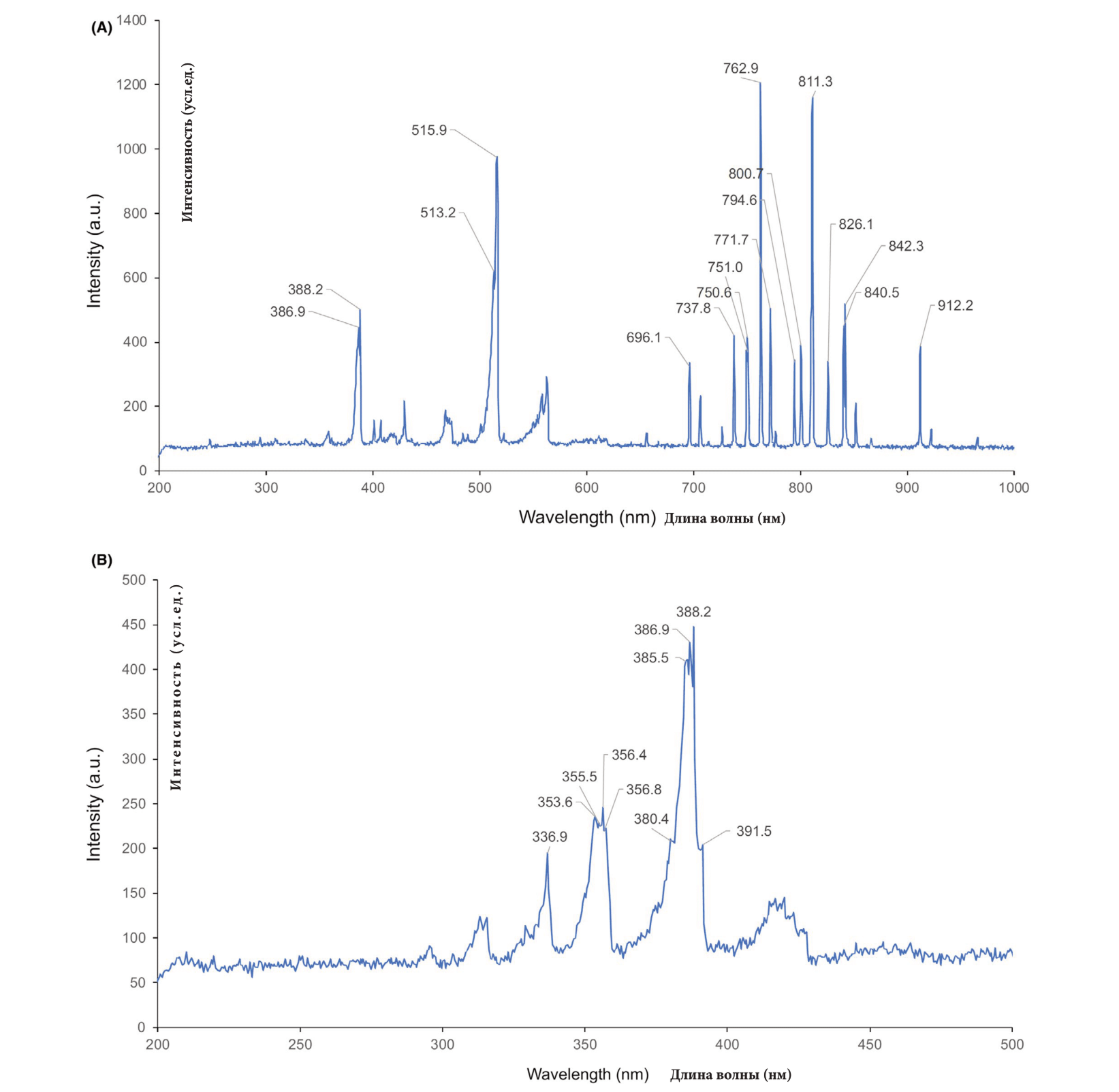
Рис. 1 Спектры испускания аргоновой и азотной плазм. Спектры испусканий (A) аргоновой плазмы и (B) ) азотной были измерены спектрометром.
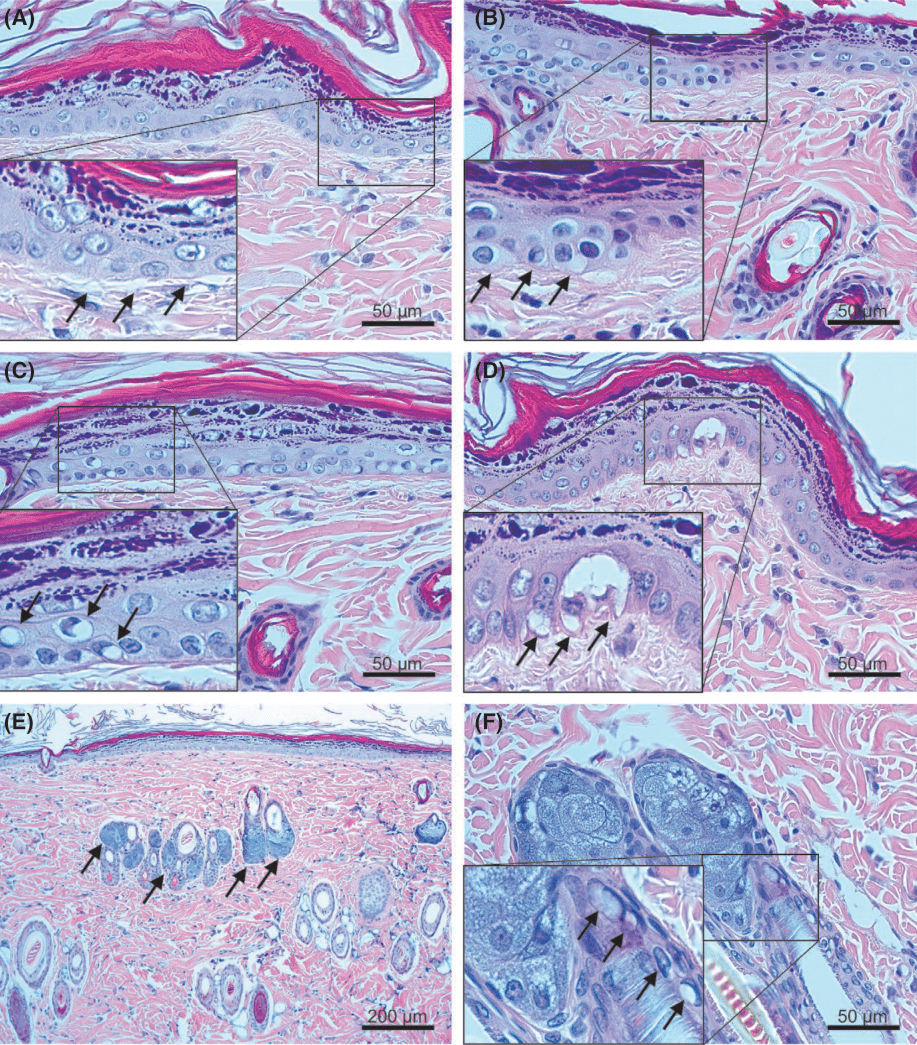
Рис. 2 Реакции тканей немедленного типа на импульс плазмы. На кожу крысы было оказано одно воздействие аргоновой плазмой с настройками: (А) 0.25 Дж, (В) 0.35 Дж, (С) 0.75 Дж, (D) 1.3 Дж, (E) 0.45 Дж и (F) 1.3 Дж. Выделенные области на изображениях — это крупные планы дермо-эпидермальных соединений со (А) средними линиями Лангера (обозначенными стрелками) и (B) средним отеком кератиноцитов (стрелки), (C) реакциями перинуклеарной вакуолизации с пиктоничными ядрами (стрелки) и (D) несколькими некротическими вакуолями (стрелки) в нижних слоях эпидермиса. (E, F) Реакции тканей от серого до черного цвета в сальных железах (E, стрелки) и (F, выделенные области) реакции перинуклеарной вакуолизации с пиктоничными ядрами (стрелки) в фолликулярном эпидермисе. Окрашивание гематоксилином и эозином при первичном увеличении (A-D, F)х400 и (E)х100. (А-D, F) масштаб = 50 мкм, (E) масштабная метка = 200 мкм.
При настройке энергии, равной 1.3 Дж, обнаружено несколько некротических вакуолей (Изобр.2D). При экспериментальных настройках 0.45−1.3 Дж выявлены реакции тканей, окрашенные в оттенки от серого до черного, с и без реакций перинуклеарной вакуолизации с пикнотическими ядрами в фолликулярном эпидермисе, однако, этого не наблюдалось при настройках в 0.25 и 0.35 Дж. (Изобр. 2E, F).
Образцы кожи крыс, обработанные пятью импульсами аргоновой плазмы с настройками в 0.35, 0.45, 0.6, 0.75 и 0.85 Дж, продемонстрировали эозинофилы, истончение эпидермиса, легкую до умеренной инфильтрацию клеток воспаления в верхних слоях дермы, и гомогенные термические реакции тканей, окрашенные в оттенки от серого до черного в сальных железах без заметной карбонизации (Изобр. 3А, B). Кожа крыс, обработанная 15 импульсами аргоновой плазмы, продемонстрировала некротические вакуольные изменения тканей в нижних слоях эпидермиса и фолликулярном эпидермисе при настройках энергии в 0.45 Дж (Изоб. 3С). Однако, при настройках импульса в 0.8 и 1.3 Дж 15 импульсы аргоновой плазмы сгенерировали некротические вакуольные изменения тканей во всем эпидермисе, также была отмечена заметная коагуляция тканей в верхних слоях папиллярной дермы с перенасыщенными дермо-сосудистыми компонентами (Изобр. 3D). Кроме того, 15 импульсов аргоновой плазмы вызвали различную степень карбонизации сальных желез, в зависимости от настроек энергии.
Образцы кожи крыс, обработанные пятью импульсами аргоновой плазмы с настройками в 0.35, 0.45, 0.6, 0.75 и 0.85 Дж, продемонстрировали эозинофилы, истончение эпидермиса, легкую до умеренной инфильтрацию клеток воспаления в верхних слоях дермы, и гомогенные термические реакции тканей, окрашенные в оттенки от серого до черного в сальных железах без заметной карбонизации (Изобр. 3А, B). Кожа крыс, обработанная 15 импульсами аргоновой плазмы, продемонстрировала некротические вакуольные изменения тканей в нижних слоях эпидермиса и фолликулярном эпидермисе при настройках энергии в 0.45 Дж (Изоб. 3С). Однако, при настройках импульса в 0.8 и 1.3 Дж 15 импульсы аргоновой плазмы сгенерировали некротические вакуольные изменения тканей во всем эпидермисе, также была отмечена заметная коагуляция тканей в верхних слоях папиллярной дермы с перенасыщенными дермо-сосудистыми компонентами (Изобр. 3D). Кроме того, 15 импульсов аргоновой плазмы вызвали различную степень карбонизации сальных желез, в зависимости от настроек энергии.
Аллергическая реакция тканей замедленного типа на импульсы аргоновой плазмы
Пять импульсов аргоновой плазмы с настройками 0.35, 0.45, 0.6, 0.75 и 0.85 Дж сгенерировали реакции вакуолизации ядер в пикнотических ядрах эпидермиса и ядерную инфильтрацию с расширенными микрососудистыми компонентами в верхних слоях дермы на день 1 и 5 после процедуры (Изобр. 4А). Вероятно, степень микроскопической реакции тканей зависит от настроек энергии. Кроме того, микроскопические вакуольные изменения тканей также были обнаружены в фолликулярном эпидермисе дистрофических сальных желез (Изобр. 4В). На 7 день образцы кожи продемонстрировали инфильтрацию клеток воспаления в верхних слоях дермы (Изобр.4С), однако на 21 день было отмечено полное восстановление эпидермальных и дермальных компонентов, за исключением сальных желез с термическими реакциями на стимуляцию плазмой (Изобр. 4D).
На 10 день после проведения аргоновой процедуры с настройками 0.45 Дж и 15 прохождениями по обрабатываемой зоне образцы кожи продемонстрировали полную реэпитализацию с плотной клеточной инфильтрацией и неоколлагенезом в верхних слоях папиллярной дермы. При этом сохранились пилосебацейные комплексы (Изобр. 4Е). Тем временем, образцы, обработанные при настройках в 1.3 Дж с 15 прохождениями, продемонстрировали неполную эпитализацию и плотную клеточную инфильтрацию в верхних и средних слоях дермы с разрушением пилосебацейных комплексов на 10 день (Изобр. 4F).
На 10 день после проведения аргоновой процедуры с настройками 0.45 Дж и 15 прохождениями по обрабатываемой зоне образцы кожи продемонстрировали полную реэпитализацию с плотной клеточной инфильтрацией и неоколлагенезом в верхних слоях папиллярной дермы. При этом сохранились пилосебацейные комплексы (Изобр. 4Е). Тем временем, образцы, обработанные при настройках в 1.3 Дж с 15 прохождениями, продемонстрировали неполную эпитализацию и плотную клеточную инфильтрацию в верхних и средних слоях дермы с разрушением пилосебацейных комплексов на 10 день (Изобр. 4F).
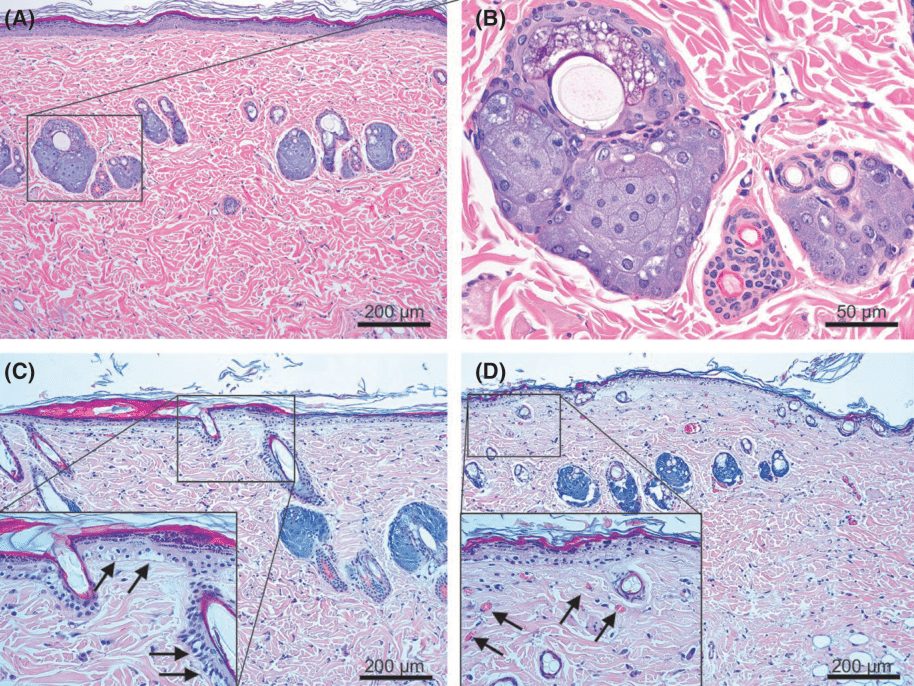
Рис. 3 Аллергические реакции тканей немедленного типа на импульс аргоновой плазмы. На кожу крысы было оказано (А, В) пять воздействий аргоновой плазмой с настройками 0.45 Дж, (С) 15 воздействий с - 0.45 Дж, (D) 15 воздействий с - 1.3 Дж. (А) Утончение эпидермиса, легкая до умеренной инфильтрация клеток воспаления в верхних слоях дермы, термические реакции тканей сальных желез. (В) Крупный план термических реакций тканей сальных желез. (С) Некротические вакуолярные изменения тканей в нижних слоях эпидермиса и фолликулярном эпидермисе (стрелки в выделенной области указываются на вакуолизацию, стимулированную плазмой). (D) Некротические вакуолярные изменения тканей во всем эпидермисе и коагуляция тканей в верхних слоях папиллярной дермы (стрелки в выделенной области показывают перенасыщенные дермо-сосудистые компоненты). Следы окрашивания гематоксилином и эозином при первичном увеличении (А, C, D)х100 и (D)х400. (А, C, D) масштабная метка = 200 мкм, (В) масштабная метка = 50 мкм.
Аллергическая реакция немедленного типа в тканях после стимуляции азотной плазмой
Азотная плазма продемонстрировала пики спектра на длине волны в 336.9, 353.6, 355.5, 356.4, 356.8, 380.4, 385, 386.9, 388.2 и 391.5 нм (Рис. 1B). Одно прохождение азотной плазмой с настройкой энергии в 0.5 Дж не привело к заметным изменениям в эпидермисе, но отмечались средне расширенные дермальные микрососудистые компоненты в верхних слоях дермы, в сравнении с кожей крыс, которая не претерпела никаких процедур. Кожа крыс, прошедшая обработку одним прохождением азотной плазмы при настройках энергии в 1.0−4.0 Дж, продемонстрировала эозинофильные термические реакции тканей во всем эпидермисе с или без микроскопических вакуольных изменений в эпидермальных клетках и средне расширенные дермальные микрососудистые компоненты в верхних слоях дермы (Изобр. 5А, В). Значительные реакции тканей, обозначенные оттенками от серого до черного, в сальных железах были обнаружены при экспериментальных настройках 1.0.-4.0 Дж с или без реакций ядерной вакуолизации в фолликулярном эпидермисе. При этом термические повреждения, казалось, не зависели от настроек энергии (данные не отображены).
Кожа крыс, обработанная пятью прохождениями азотной плазмы с настройками энергии в 1.0, 1.5, 2.0, 2.5 и 3.0 Дж, продемонстрировала утончение и коагуляцию всего эпидермиса. Обширный коагуляционный некроз от верхних до срединных слоев дермы был обнаружен при настройках энергии в 1.0−3.0 Дж. Глубина и степень коагуляции тканей увеличивались в прямой зависимости от увеличения значения энергии. (Изображение 5C, D). Заметные линии Лангера были обнаружены в дермо-эпидермальных соединениях и верхних и средних слоях дермы. Степень образовавшейся карбонизации и коагуляции сальных желез были в обратной зависимости от коагуляционного некроза тканей в эпидермисе и дерме (данные не отображены). Тем временем, кожа крыс, претерпевшая 15 прохождений азотной плазмой с настройками энергии в 1.5, 2.75 и 4 Дж, продемонстрировала обширный коагуляционный некроз эпидермиса и средних слоев дермы, включая часть пилосебацейных комплексов, по сравнению с кожей, претерпевшей только пять прохождений (Рис. 5Е). Реакции тканей в 1 день после процедуры с азотной плазмой при 2.75 Дж и 15 прохождениях продемонстрировали более обширный некроз тканей в эпидермисе и средних слоях дермы по сравнению с аллергическими реакциями тканей в день 0 (Рис. 5F). Кроме того, некротические пилосебацейные комплексы с карбонизированными сальными железами были выявлены в крупных участках некротической ткани в дерме.
Кожа крыс, обработанная пятью прохождениями азотной плазмы с настройками энергии в 1.0, 1.5, 2.0, 2.5 и 3.0 Дж, продемонстрировала утончение и коагуляцию всего эпидермиса. Обширный коагуляционный некроз от верхних до срединных слоев дермы был обнаружен при настройках энергии в 1.0−3.0 Дж. Глубина и степень коагуляции тканей увеличивались в прямой зависимости от увеличения значения энергии. (Изображение 5C, D). Заметные линии Лангера были обнаружены в дермо-эпидермальных соединениях и верхних и средних слоях дермы. Степень образовавшейся карбонизации и коагуляции сальных желез были в обратной зависимости от коагуляционного некроза тканей в эпидермисе и дерме (данные не отображены). Тем временем, кожа крыс, претерпевшая 15 прохождений азотной плазмой с настройками энергии в 1.5, 2.75 и 4 Дж, продемонстрировала обширный коагуляционный некроз эпидермиса и средних слоев дермы, включая часть пилосебацейных комплексов, по сравнению с кожей, претерпевшей только пять прохождений (Рис. 5Е). Реакции тканей в 1 день после процедуры с азотной плазмой при 2.75 Дж и 15 прохождениях продемонстрировали более обширный некроз тканей в эпидермисе и средних слоях дермы по сравнению с аллергическими реакциями тканей в день 0 (Рис. 5F). Кроме того, некротические пилосебацейные комплексы с карбонизированными сальными железами были выявлены в крупных участках некротической ткани в дерме.
Аллергические реакции тканей замедленного типа на воздействие азотной плазмой
При низких настройках энергии в 1.0, 1.5 и 2.0 Дж пять прохождений азотной плазмой незамедлительно привели к коагуляции тканей на глубине 31.5± 8.3, 94.9±16.9 и 171.6±19.7 мкм, соответственно (Изобр. 6). На день 1 гистологические особенности некротической коагуляции были выявлены во всем эпидермисе. Реэпитализация была заметна от нижних слоев эпидермиса при настройках энергии в 1.5 и 2.0 Дж, но не 1.0 Дж. Полная реэпитализация была отмечена на 5 день в участках кожи, претерпевших обработку при 1.5 Дж и на 7 день — при 2.0 Дж. К дню 21 участки кожи, окрашенные гематоксилином и эозином и прошедшие трихромное окрашивание по Массону, прошедшие процедуры при настройках энергии в 1.0, 1.5 и 2.0 Дж, показали значительные увеличения фибробластов и волокон коллагена в верхних слоях дермы на глубине 79.7± 8.6, 98.7± 14.0 и 134.6± 10.8 мкм, соответственно.
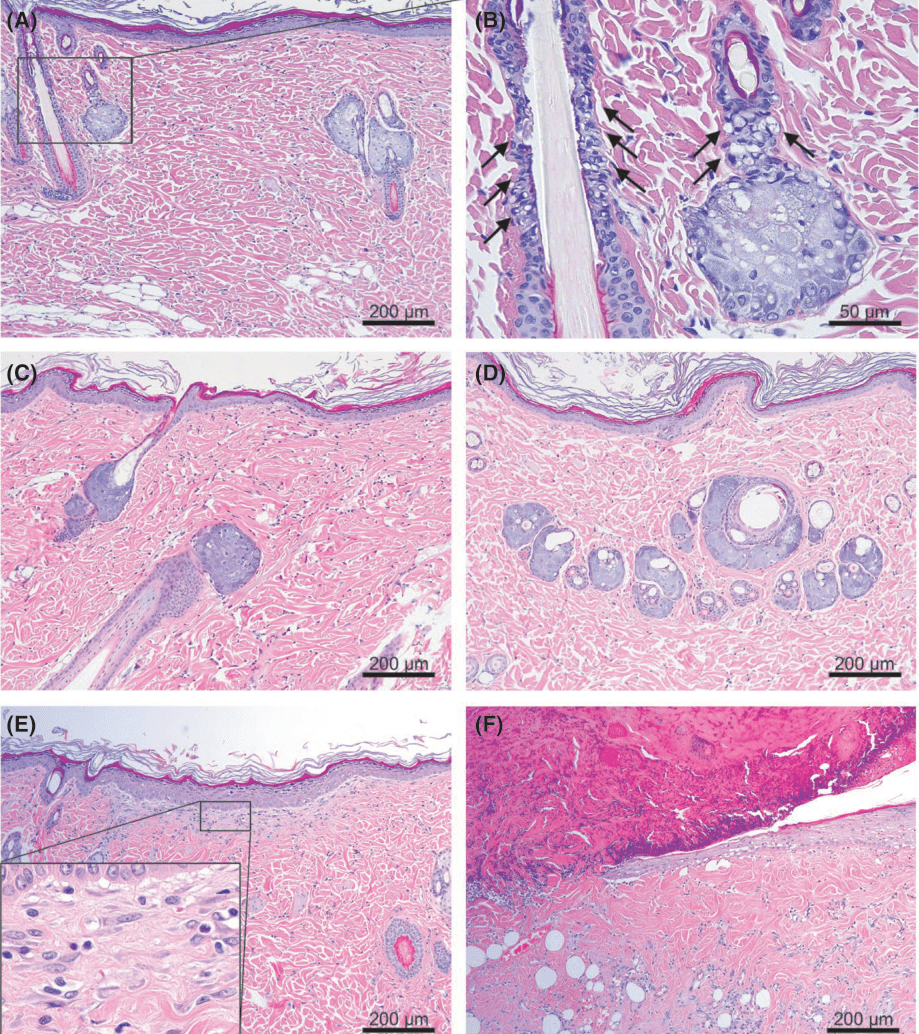
Рис. 4 Аллергические реакции тканей замедленного типа после нескольких прохождений аргоновой плазмой. Кожа крыс претерпела пять прохождений аргоновой плазмой с настройками энергии в (А, B) 0.85 Дж и (C, D) 0.75 Дж и 15 прохождений аргоновой плазмой с настройками энергии в (E) 0.45 Дж и (F) 1.3 Дж. (А, B) День 1, © день 7, (D) день 21 и (E, F) день 10 после процедуры обработки аргоновой плазмой. (B) Микроскопические вакуольные изменения в тканях (обозначены стрелками) в фолликулярном эпидермисе с дистрофичными сальными железами. (E) Полная реэпитализация со значительными вакуолями (стрелки) в дермо-эпидермальных соединениях. Следы окрашивания гематоксилином и эозином при первичном увеличении (А, С- F) х100 и (B)х400. (А, C-F) масштабная метка = 200 мкм, (B) масштабная метка = 50 мкм.
При высоких настройках энергии в 2.5 и 3.0 Дж пять прохождений азотной плазмой незамедлительно сгенерировали заметную коагуляцию тканей на глубине 381.7±33.6 и 456.3±75.7 мкм, соответственно (Рис. 7). В день 1 гистологические особенности обширной некротической коагуляции были обнаружены во всем эпидермисе и верхних слоях дермы, за исключением сальных желез при 2.5 Дж, и включая сальные железы при 3.0 Дж. Реэпитализация была незаметна в день 1. Тем не менее, полная реэпитализация наблюдалась на 7 день при обеих настройках энергии. На 21 день заметные увеличения в фибробластах и коллагеновых волокнах в верхних и средних слоях дермы были отмечены на глубине 395.7± 23.0 и 846.7±26.1 мкм при 2.5 и 3.0 Дж, соответственно (Рис. 8). Тем временем реакции ткани на 10 день после 15 проходок азотной плазмы при 1.5, 2.75 и 4.0 Дж предстали в виде язвенных образования на коже крыс с неполной эпитализацией и плотной клеточной инфильтрацией с полностью разрушенными пилосебацейными комплексами (данные не отображены).
05
Обсуждение
В настоящем исследовании мы создавали микроскопические реакции тканей кожи и кожных придатков на стимуляцию плазмой в лабораторных условиях на животных моделях. При различных экспериментальных настройках аргоновая и азотная плазма подавались на кожу крыс. Единственный импульс аргоновой плазмы вызвали вакуольные изменения в клетках эпидермиса при низких настройках энергии в 0.35−1.3 Дж с и без некротических эозинофильных изменений. Единственный импульс азотной плазмы привел к вакуольным изменениям в клетках эпидермиса при низких настройках энергии в 1−2 Дж, при этом некротические эозинофильные изменения эпидермиса были заметны при 2.5−4 Дж. 5 и 15 импульсов аргоновой и азотной плазмы привели к слишком ранним некротическим изменениям в эпидермисе, вместо вакуольных изменений. Данные особенности сопоставимы с гистологическими результатами предыдущих исследований: в рамках эксперимента кожа свиньи подверглась воздействию азотной плазмы через 6-миллиметровое сопло с настройкой энергии в 1−3 Дж, были образованы зоны термических повреждений на глубине не более 11 мкм. В это же время единственный импульс азотной плазмы при настройке энергии в 4 Дж создал зону термического повреждения, которая распространилась на глубину до 13 мкм. Любопытно, что большое количество импульсов азотной плазмы при настройке энергии в 1−4 Дж сгенерировало термические реакции ткани схожие с теми, что образовались от одного импульса, за исключением импульса азотной плазмы при 2 Дж. Кроме того, гистологические особенности эпидермального некроза стали более заметны при 2−4 Дж без четкой корреляции между настройками энергии и степенью некроза, полностью восстановившийся эпидермис был получен через 5 дней после процедуры с азотной плазмой. Тем не менее, в нашем исследовании и в другом лабораторном исследовании на людях микроскопические изменения тканей в виде вакуолизации или некроза в эпидермисе были заметны при относительно низких настройках энергии.
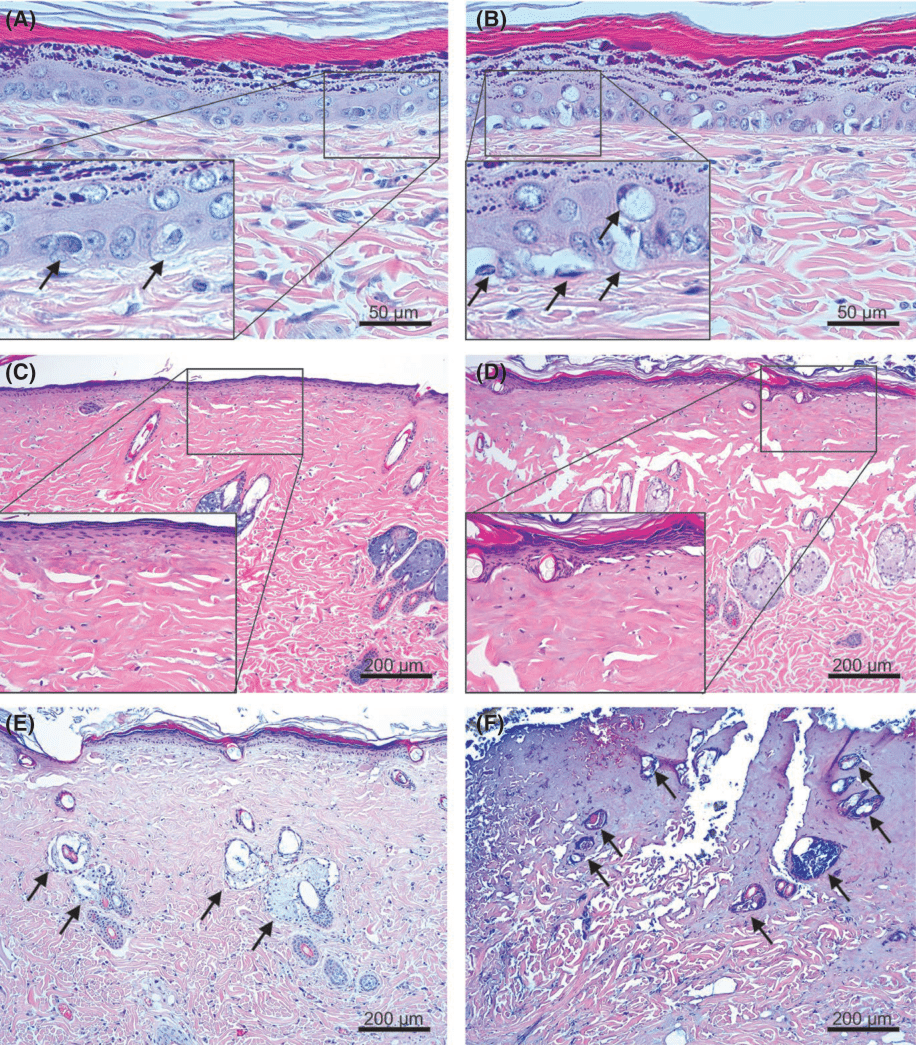
Рис. 5 Аллергические реакции тканей незамедлительного типа на стимуляцию азотной плазмой после одного или нескольких импульсов. Кожа крыс претерпела воздействие азотной плазмой в (А) 1.0 Дж с одним прохождением, (B) 2.5 Дж с одним прохождением, © 1.5 Дж с 5 прохождениями, (D) 2.0 Дж с 5 прохождениями и (E, F) 2.75 Дж с 15 прохождениями. День 0 (А-E) и день 1 (F) после процедур с азотной плазмой. В выделенных областях показаны крупные планы дермо-эпидермальных соединений с (А, B) микроскопическими вакульоными изменениями в клетках эпидермиса (стрелки) и (C, D) энергетически зависимый коагуляционный некроз в эпидермисе и дерме (E, F). Стрелки указывают на сальные железы с коагуляционным некрозом после процедур с азотной плазмой. Следы окрашивания гематоксилином и эозином при первичном увеличении (А, B) х 400 и (C-F) х 100. (А, B) масштабная метка = 50 мкм, (C-F) масштабная метка = 200 мкм.
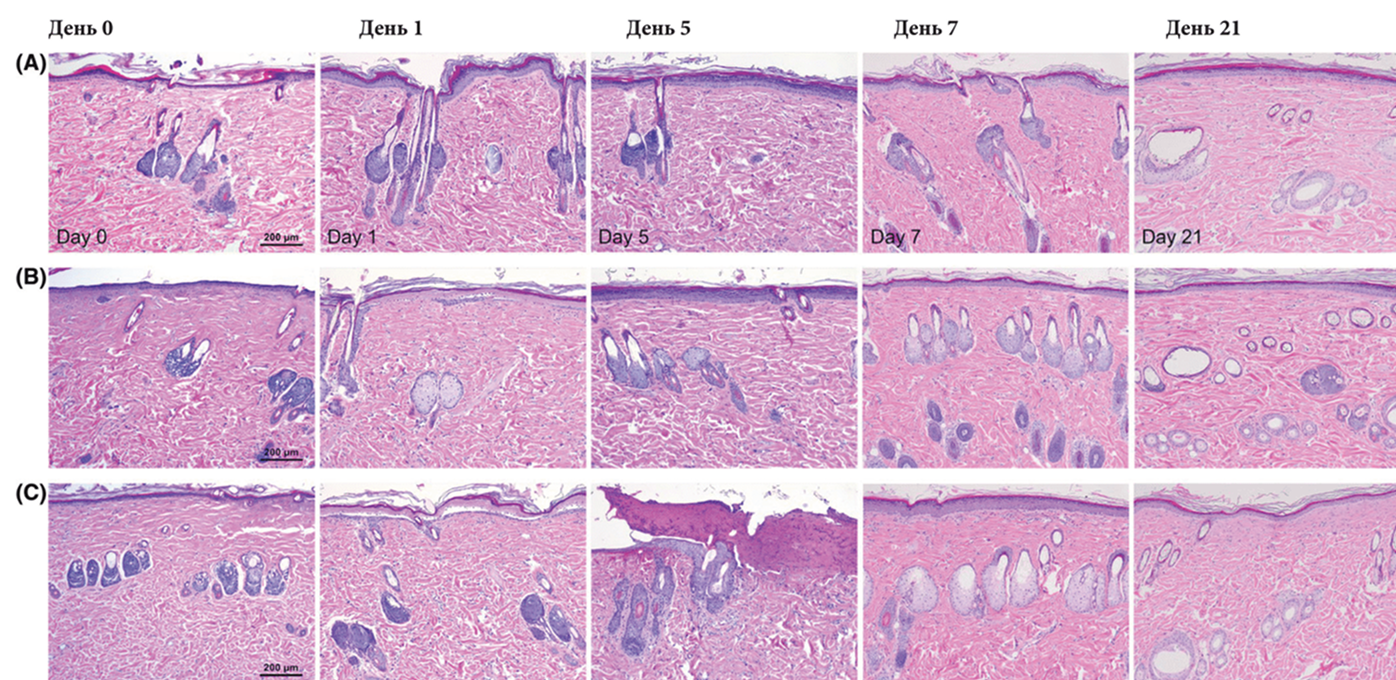
Рис. 6 Аллергические реакции тканей замедленного типа после стимуляции азотной плазмой при низких настройках энергии. Кожа крыс претерпела пять прохождения азотной плазмой при (А) 1.0 Дж, (B) 1.5 Дж и (C) 2.0 Дж. Образцы были отобраны на день 0, день 1, день 5, день 7 и день 21. Окрашивание гематоксилином и эозином при первичном увеличении х 100. Масштабная метка = 200 мкм.
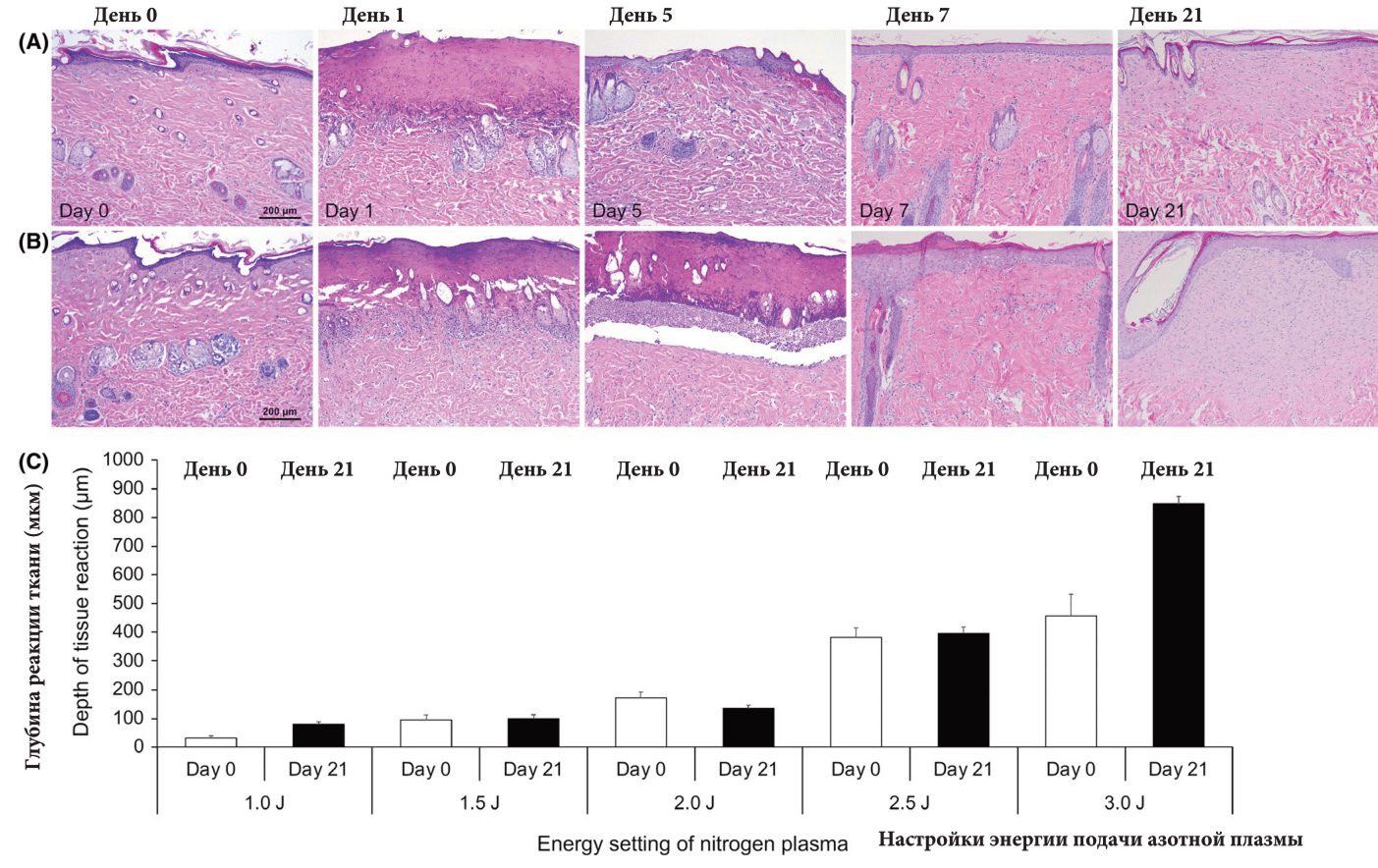
Рис. 7 Аллергические реакции тканей замедленного типа на стимуляцию азотной плазмой с высокими настройками подаваемой энергии. Кожа крыс претерпела пять прохождений азотной плазмой при (А) 2.5 Дж и (В) 3.0 Дж. Образцы были получены на 0 день, 1 день, 5 день, 7 день и 21 день. Окрашивание гематоксилином и эозином при первичном увеличении. Масштабная метка = 200 мкм. © Измеренная глубина реакции тканей на стимуляцию азотной плазмой при настройках энергии в 1.0, 1.5, 2.0, 2.5 и 3.0 Дж после 5 прохождений. Белые колонки обозначают максимальную глубину коагуляции тканей на 0 день, черные колонки — максимальную глубину зон увеличения фибробластов и коллагеновых волокон на 21 день.
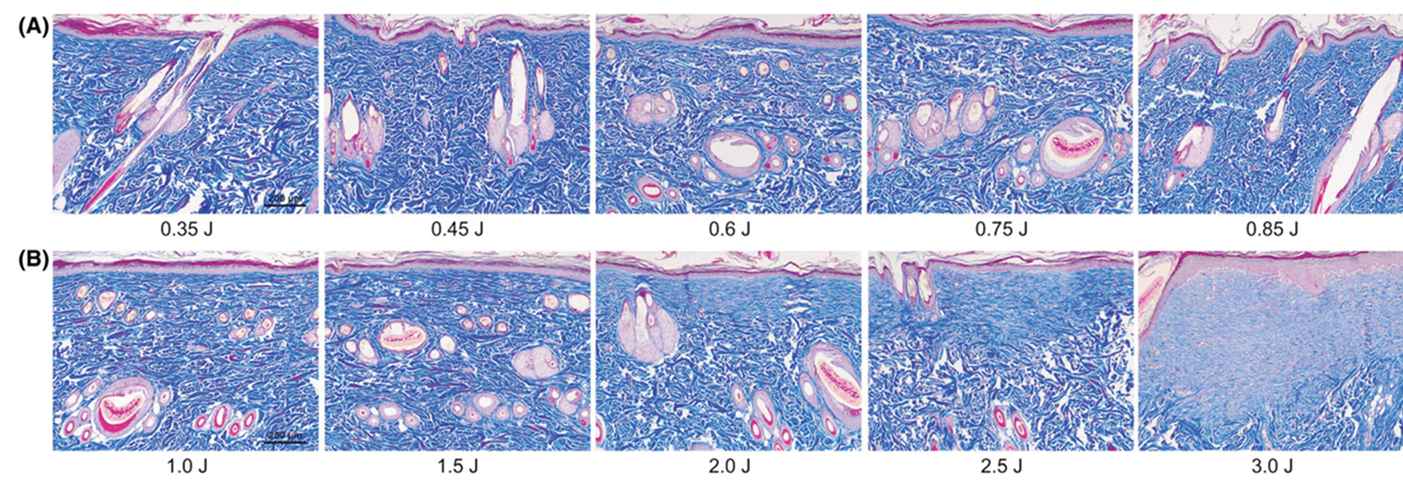
Рис. 8 Аллергические реакции тканей замедленного типа на стимуляцию аргоновой и азотной плазмой. Кожа крыс подверглась пяти прохождениям (А) аргоновой и (В) азотной плазмой. Образцы были получены на 21 день. Трихромное окрашивание по Массону при первичном увеличении х 100. Масштабная метка = 200 мкм.
В предыдущем исследовании, в рамках которого оценивалось процентное соотношение нетронутых тканей эпидермиса, взятых на биопсию в разное время после процедуры плазменной регенерации с использованием азотной плазмы, исследователи продемонстрировали, что низкие настройки энергии привели к более существенному некрозу тканей эпидермиса в 0 день, чем в 2 день после процедуры. При этом, высокие настройки энергии привели к образованию более обширных зон эпидермального некроза на 2 день, чем в 0 день. В текущем исследовании степень реакций эпидермиса на стимуляцию плазмой была выше в образцах тканей на 1 день по всем экспериментальным настройкам, чем в 0 день. Образцы продемонстрировали полное или частичное восстановление на 5,7 и 10 дни вместе с высокой инфильтрацией клеток воспаления и неоколлагенезом.
В настоящем отчете мы определили, что проведение процедур с аргоновой плазмой приводит к микроскопическим изменениям в сальных железах и фолликулярном эпителии, при этом сохраняя структурную целостность пилосебацейных комплексов и отдельных себоцитов внутри них. Данные гистологические изменения сохранялись до 3 недель. Одновременно с этим азотная плазма вызвала микроскопические изменения, как термического разрушения, так и модификации пилосебацейных комплексов, в зависимости от настроек энергии и количества поданных импульсов, а именно: процедура с высокими настройками энергии и большим количеством прохождений вызвала обширную коагуляцию тканей в эпидермисе, верхних и средних слоях дермы и сальных железах, что привело к отложенному заживлению ран и образованию шрамов. В рамках предыдущего исследования предполагалось, что реакции ткани на стимуляцию плазмой, включая вакуольные изменения, ограничивают обширность термических повреждений, блокируя дальнейшее проникновение энергии плазмы в более глубокие ткани. Таким образом, реакции тканей на процедуру с низким уровнем энергии характеризуются как «ограниченные эпидермисом и дермо-эпидермальными соединениями», при этом процедуры с высоким уровнем энергии ограничиваются папиллярной дермой. С учетом результатов данного исследования мы считаем, что глубина термических реакций тканей на несколько прохождений азотной плазмой при высоких настройках энергии ограничено сальными железами и окружающими их компонентами дермы. Кроме того, мы предполагаем, что степень термических повреждений тканей сальных желез после стимуляции плазмой значительно определяет риск формирования шрамов после процедур. Тем не менее, так как импульсы и аргоновой, и азотной плазмы продемонстрировали множественные и гетерогенные спектры испускания, эффекты от каждого спектра испускания на коже и кожных придатках не могут быть определен в рамках данного исследования.
Нетермические процедуры с плазмой показали ускорение процесса реэпитализации ран и увеличение воспроизводства сосудистых компонентов и стромальной ткани. Кроме того, процедура с плазмой, похоже, значительно сократила фазу воспаления во время заживления ран. Соответственно, положительные терапевтические эффекты были отмечены для использования нетермической плазмы в лечении пролежней, ожогов, экземы и акне. В нашем исследовании реакции ткани на плазмы в фолликулярном эпителии и сальных железах были достигнуты с импульсами аргоновой и азотной плазмы при низких настройках подачи энергии без весомых результатов в коагуляции тканей дермы. Соответственно, мы считаем, что сальные железы могут быть селективно модифицированы и повреждены при выборе правильного газообразного источника для генерации плазмы и регулировании настроек энергии без образования термического некроза дермы. Это поддерживает положительные эффекты, описанные в предыдущем исследовании лечения акне и неконтролируемой выработки кожного сала с помощью плазмы, основанного на реакции на плазму Propionibacterium acnes, и дермального воспаления, и измененной фолликулярной среды.
Чтобы подчеркнуть реакции тканей на стимуляцию плазмой, в данном отчете мы провели гистологическое исследование образцов кожи крыс, взятых в лабораторных условиях после пяти прохождений азотной плазмой на 0 день, 1 день, 5 день, 7 день и 21 день. Паттерны аллергических реакций тканей немедленного типа и отложенной регенерации тканей были очень заметны.
При этом паттерны термических реакций незамедлительного типа и отложенная генерация тканей существенно отличались при низких и высоких настройках процедур с азотной плазмой. После пяти прохождений глубина термической коагуляции тканей немедленного типа после стимуляции азотной плазмой в 0 день постепенно увеличивалась в зависимости от уровня энергии при низких настройках подачи энергии в 1.0, 1.5 и 2.0 Дж. Между тем глубина термической коагуляции тканей сильно увеличивалась в зависимости от уровня энергии при высоких настройках подачи энергии в 2.5 и 3.0 Дж, как показано на Изобр. 6 В. Кроме того, толщина зон увеличенных фибробластов и коллагеновых волокон на 21 день значительно увеличилась при низких настройках энергии в 1.0, 1.5 и 2.0 Дж и резко увеличилась при высоких настройках энергии при 2.5 и 3.0 Дж. Мы считаем, что термические реакции тканей на стимуляцию плазмой могли быть ограничены соответствующими структурными компонентами, включая базальную мембрану, микрососудистые сплетения в верхних слоях папиллярной дермы, верхних и нижних слоях сальных желез. Тем не менее, требуется проведение дополнительных исследований для подтверждения полученных нами результатов. Невзирая на это, мы считаем, что наши лабораторные крысы с тонким роговым слоем эпидермиса, достаточными кожными придатками и микрососудистыми компонентами являются подходящими примерами для определения ранних и минимальных микроскопических изменений в тканях, стимулированных процедурами с аргоновой и азотной плазмой.
В заключение можно сказать, что наше исследование, проведенное на коже лабораторных крыс, показало, что импульсы аргоновой плазмы генерируют заметные гистологические изменения в виде клеточной вакуолизации, коагуляции тканей, термической модификации в эпидермальных и фолликулярных кератиноцитах, микрососудистых компонентах и коллагеновых волокнах в верхних слоях папиллярной дермы и сальных железах без существенных термических повреждений в дерме. При этом процедура с импульсами азотной плазмы привела к энергозависимой термической коагуляции тканей в эпидермисе и дерме наряду с карбонизацией сальных желез, что привело к неоколлагенезу. Наши результаты представлены в виде описания данных, однако, в них не представлен квантитативный анализ гетерогенной природы газообразных источников и различных экспериментальных настроек процедур с плазмой. Таким образом, более контролируемые, квантитативные эксперименты следует провести, чтобы подтвердить полученные нами результаты. Однако, мы считаем, что результаты нашего исследования могут быть использованы практикующими врачами для определения параметров проведения процедур с источниками аргона и азота, а именно для процедур с низкими или высокими настройками подачи энергии при одном или нескольких прохождениях по коже в рамках различных медицинских процедур.
В настоящем отчете мы определили, что проведение процедур с аргоновой плазмой приводит к микроскопическим изменениям в сальных железах и фолликулярном эпителии, при этом сохраняя структурную целостность пилосебацейных комплексов и отдельных себоцитов внутри них. Данные гистологические изменения сохранялись до 3 недель. Одновременно с этим азотная плазма вызвала микроскопические изменения, как термического разрушения, так и модификации пилосебацейных комплексов, в зависимости от настроек энергии и количества поданных импульсов, а именно: процедура с высокими настройками энергии и большим количеством прохождений вызвала обширную коагуляцию тканей в эпидермисе, верхних и средних слоях дермы и сальных железах, что привело к отложенному заживлению ран и образованию шрамов. В рамках предыдущего исследования предполагалось, что реакции ткани на стимуляцию плазмой, включая вакуольные изменения, ограничивают обширность термических повреждений, блокируя дальнейшее проникновение энергии плазмы в более глубокие ткани. Таким образом, реакции тканей на процедуру с низким уровнем энергии характеризуются как «ограниченные эпидермисом и дермо-эпидермальными соединениями», при этом процедуры с высоким уровнем энергии ограничиваются папиллярной дермой. С учетом результатов данного исследования мы считаем, что глубина термических реакций тканей на несколько прохождений азотной плазмой при высоких настройках энергии ограничено сальными железами и окружающими их компонентами дермы. Кроме того, мы предполагаем, что степень термических повреждений тканей сальных желез после стимуляции плазмой значительно определяет риск формирования шрамов после процедур. Тем не менее, так как импульсы и аргоновой, и азотной плазмы продемонстрировали множественные и гетерогенные спектры испускания, эффекты от каждого спектра испускания на коже и кожных придатках не могут быть определен в рамках данного исследования.
Нетермические процедуры с плазмой показали ускорение процесса реэпитализации ран и увеличение воспроизводства сосудистых компонентов и стромальной ткани. Кроме того, процедура с плазмой, похоже, значительно сократила фазу воспаления во время заживления ран. Соответственно, положительные терапевтические эффекты были отмечены для использования нетермической плазмы в лечении пролежней, ожогов, экземы и акне. В нашем исследовании реакции ткани на плазмы в фолликулярном эпителии и сальных железах были достигнуты с импульсами аргоновой и азотной плазмы при низких настройках подачи энергии без весомых результатов в коагуляции тканей дермы. Соответственно, мы считаем, что сальные железы могут быть селективно модифицированы и повреждены при выборе правильного газообразного источника для генерации плазмы и регулировании настроек энергии без образования термического некроза дермы. Это поддерживает положительные эффекты, описанные в предыдущем исследовании лечения акне и неконтролируемой выработки кожного сала с помощью плазмы, основанного на реакции на плазму Propionibacterium acnes, и дермального воспаления, и измененной фолликулярной среды.
Чтобы подчеркнуть реакции тканей на стимуляцию плазмой, в данном отчете мы провели гистологическое исследование образцов кожи крыс, взятых в лабораторных условиях после пяти прохождений азотной плазмой на 0 день, 1 день, 5 день, 7 день и 21 день. Паттерны аллергических реакций тканей немедленного типа и отложенной регенерации тканей были очень заметны.
При этом паттерны термических реакций незамедлительного типа и отложенная генерация тканей существенно отличались при низких и высоких настройках процедур с азотной плазмой. После пяти прохождений глубина термической коагуляции тканей немедленного типа после стимуляции азотной плазмой в 0 день постепенно увеличивалась в зависимости от уровня энергии при низких настройках подачи энергии в 1.0, 1.5 и 2.0 Дж. Между тем глубина термической коагуляции тканей сильно увеличивалась в зависимости от уровня энергии при высоких настройках подачи энергии в 2.5 и 3.0 Дж, как показано на Изобр. 6 В. Кроме того, толщина зон увеличенных фибробластов и коллагеновых волокон на 21 день значительно увеличилась при низких настройках энергии в 1.0, 1.5 и 2.0 Дж и резко увеличилась при высоких настройках энергии при 2.5 и 3.0 Дж. Мы считаем, что термические реакции тканей на стимуляцию плазмой могли быть ограничены соответствующими структурными компонентами, включая базальную мембрану, микрососудистые сплетения в верхних слоях папиллярной дермы, верхних и нижних слоях сальных желез. Тем не менее, требуется проведение дополнительных исследований для подтверждения полученных нами результатов. Невзирая на это, мы считаем, что наши лабораторные крысы с тонким роговым слоем эпидермиса, достаточными кожными придатками и микрососудистыми компонентами являются подходящими примерами для определения ранних и минимальных микроскопических изменений в тканях, стимулированных процедурами с аргоновой и азотной плазмой.
В заключение можно сказать, что наше исследование, проведенное на коже лабораторных крыс, показало, что импульсы аргоновой плазмы генерируют заметные гистологические изменения в виде клеточной вакуолизации, коагуляции тканей, термической модификации в эпидермальных и фолликулярных кератиноцитах, микрососудистых компонентах и коллагеновых волокнах в верхних слоях папиллярной дермы и сальных железах без существенных термических повреждений в дерме. При этом процедура с импульсами азотной плазмы привела к энергозависимой термической коагуляции тканей в эпидермисе и дерме наряду с карбонизацией сальных желез, что привело к неоколлагенезу. Наши результаты представлены в виде описания данных, однако, в них не представлен квантитативный анализ гетерогенной природы газообразных источников и различных экспериментальных настроек процедур с плазмой. Таким образом, более контролируемые, квантитативные эксперименты следует провести, чтобы подтвердить полученные нами результаты. Однако, мы считаем, что результаты нашего исследования могут быть использованы практикующими врачами для определения параметров проведения процедур с источниками аргона и азота, а именно для процедур с низкими или высокими настройками подачи энергии при одном или нескольких прохождениях по коже в рамках различных медицинских процедур.
06
Список литературы
Богл М.А., Арндт К. А., Довер Дж. С. Оценка технологии плазменной регенерации кожи при омоложении лица с низкими настройками подаваемой энергии. Журнал: Arch Dermatol. 2007;143:168−174
Хейнлин Дж., Циммерманн Дж.Л., Земан Ф. и др. Рандомизированное экспериментальное исследование с применением плацебо холодной атмосферной аргоновой плазмы на донорских участках кожи для трансплантации. Журнал: Wound Repair Regen. 2013; 21:800−807.
Килмер С., Семчишин Н., Шах Г., Фитцпатрик Р. Экспериментальное исследование применения аппарата плазменной регенерации кожи (Portrait PSR3) для омоложения всей зоны лица. Журнал: Lasers Med Sci. 2007; 22:101−109.
Элзе М.Л., Каммер Дж.Н. Оценка эффективности технологий плазменной регенерации при ремоделировании кожи лица. Журнал: Cosmet Dermatol. 2008;7:309−311.
Фитцпатрик Р., Бернштайн Э., Айер С., Браун Д., Эндрюс П., Пенни К. Гистопатологическая оценка системы плазменной регенерации кожи (PSR) и стандартного СО2 лазера для восстановления кожи у животных. Журнал: Lasers Surg Med 2008; 40:93−99.
Сандерсон А.Р., Ву Э. Ч., Лайо Л. Х., Гарг Р., Гангнес Р. А. Эффективность применения местного анестетика при глубоком термическом ожоге, вызванным использованием аппарата плазменной регенерации кожи. Журнал: Lasers Surg Med. 2014;46:127−131.
Хейнлин Дж., Исбери Г., Штольц У. и др. Рандомизированное плацебо-исследование эффективности и безопасности использования нетермической аргоновой плазмы атмосферного давления при зуде на двух сторонах кожи. Журнал: Eur Acad Dermatol Venereol. 2013;27:324−331.
Виганд К., Бейер О., Хорн К. и др. Журнал: Антимикробное воздействие на различные виды дрожжей и бактерий в медицине с применением технологии холодной плазмы атмосферного давления. Журнал: Skin Pharmacol Physiol. 2014; 27:25−35.
Вейандт Г. Х., Бенойт С., Бекер Дж. К., Брокер Э. Б., Хамм Х. Контролируемое удаление аногенительных бородавок на разных слоях ткани кожи с применением коагуляции, вызванной аргоновой плазмой. Журнал: Dtsch Dermatol Ges. 2005; 3:271−275
Лиу Дж.Р., Сю Г. М., Ши С. М., Джан Г. Дж. Низкотемпературная плазма способствует пролиферации фибробластов путем стимулирования транскрипционного фактора κB и увеличению экспрессии Циклина D1. Журнал: Sci Rep. 2017; 7:11 698
Чен К.Я., Лин Дж.Х., Чен Ю. П., Чиу Х. И., Йе Н. Л., Ву Т. К. и др. Лечение ран с применением плазменных струй атмосферного давления у крыс с диабетом, вызванным стрептозотоцином. Журнал: Sci Rep 2018; 8:12 214.
Гонзалез М.Дж. Стургилл У. Х., Росс Э. В., Убельор Н. С. Лечение рубцов акне при помощи технологии плазменной регенерации кожи. Журнал: Lasers Surg Med. 2008; 40:124−127.
Чатрэ М., Торкмэн Г., Хани М., Салехи Х., Шокри Б. Исследование неинвазивного воздействия нетермической плазмы при лечении пролежней. Журнал: Sci Rep. 2018; 8:5621.
Чутсиримонкол Ч., Буняван Д., Полникорн Н., Течаваттханависан У., Кундилокчай Т. Использование нетермической плазмы при лечении акне и эстетического восстановления кожи. Журнал: Plasma Med. 2014; 4:79−88.
Авторы:
Хису Ким — Кафедра дерматологии и дерматобиологии, Исследовательский центр Международного госпиталя Святой Марии при Католическом медицинском университете Квандон, г. Инчхон, Южная Корея
Хюн-Жо Ким — Дерматологическая клиника CNP, г. Инчхон, Южная Корея
Хи Кюн Ким — Отделение патологий больницы города Пучхон при Университете Сунчуньян, Южная Корея
Жон Йён Хон — Кафедра дерматологии Медицинского колледжа, г. Чхонан, Южная Корея
Сан Бин Чо — Клиника дерматологии и лазерной терапии Ёнсей Серан, г. Инчхон, Южная Корея
Хейнлин Дж., Циммерманн Дж.Л., Земан Ф. и др. Рандомизированное экспериментальное исследование с применением плацебо холодной атмосферной аргоновой плазмы на донорских участках кожи для трансплантации. Журнал: Wound Repair Regen. 2013; 21:800−807.
Килмер С., Семчишин Н., Шах Г., Фитцпатрик Р. Экспериментальное исследование применения аппарата плазменной регенерации кожи (Portrait PSR3) для омоложения всей зоны лица. Журнал: Lasers Med Sci. 2007; 22:101−109.
Элзе М.Л., Каммер Дж.Н. Оценка эффективности технологий плазменной регенерации при ремоделировании кожи лица. Журнал: Cosmet Dermatol. 2008;7:309−311.
Фитцпатрик Р., Бернштайн Э., Айер С., Браун Д., Эндрюс П., Пенни К. Гистопатологическая оценка системы плазменной регенерации кожи (PSR) и стандартного СО2 лазера для восстановления кожи у животных. Журнал: Lasers Surg Med 2008; 40:93−99.
Сандерсон А.Р., Ву Э. Ч., Лайо Л. Х., Гарг Р., Гангнес Р. А. Эффективность применения местного анестетика при глубоком термическом ожоге, вызванным использованием аппарата плазменной регенерации кожи. Журнал: Lasers Surg Med. 2014;46:127−131.
Хейнлин Дж., Исбери Г., Штольц У. и др. Рандомизированное плацебо-исследование эффективности и безопасности использования нетермической аргоновой плазмы атмосферного давления при зуде на двух сторонах кожи. Журнал: Eur Acad Dermatol Venereol. 2013;27:324−331.
Виганд К., Бейер О., Хорн К. и др. Журнал: Антимикробное воздействие на различные виды дрожжей и бактерий в медицине с применением технологии холодной плазмы атмосферного давления. Журнал: Skin Pharmacol Physiol. 2014; 27:25−35.
Вейандт Г. Х., Бенойт С., Бекер Дж. К., Брокер Э. Б., Хамм Х. Контролируемое удаление аногенительных бородавок на разных слоях ткани кожи с применением коагуляции, вызванной аргоновой плазмой. Журнал: Dtsch Dermatol Ges. 2005; 3:271−275
Лиу Дж.Р., Сю Г. М., Ши С. М., Джан Г. Дж. Низкотемпературная плазма способствует пролиферации фибробластов путем стимулирования транскрипционного фактора κB и увеличению экспрессии Циклина D1. Журнал: Sci Rep. 2017; 7:11 698
Чен К.Я., Лин Дж.Х., Чен Ю. П., Чиу Х. И., Йе Н. Л., Ву Т. К. и др. Лечение ран с применением плазменных струй атмосферного давления у крыс с диабетом, вызванным стрептозотоцином. Журнал: Sci Rep 2018; 8:12 214.
Гонзалез М.Дж. Стургилл У. Х., Росс Э. В., Убельор Н. С. Лечение рубцов акне при помощи технологии плазменной регенерации кожи. Журнал: Lasers Surg Med. 2008; 40:124−127.
Чатрэ М., Торкмэн Г., Хани М., Салехи Х., Шокри Б. Исследование неинвазивного воздействия нетермической плазмы при лечении пролежней. Журнал: Sci Rep. 2018; 8:5621.
Чутсиримонкол Ч., Буняван Д., Полникорн Н., Течаваттханависан У., Кундилокчай Т. Использование нетермической плазмы при лечении акне и эстетического восстановления кожи. Журнал: Plasma Med. 2014; 4:79−88.
Авторы:
Хису Ким — Кафедра дерматологии и дерматобиологии, Исследовательский центр Международного госпиталя Святой Марии при Католическом медицинском университете Квандон, г. Инчхон, Южная Корея
Хюн-Жо Ким — Дерматологическая клиника CNP, г. Инчхон, Южная Корея
Хи Кюн Ким — Отделение патологий больницы города Пучхон при Университете Сунчуньян, Южная Корея
Жон Йён Хон — Кафедра дерматологии Медицинского колледжа, г. Чхонан, Южная Корея
Сан Бин Чо — Клиника дерматологии и лазерной терапии Ёнсей Серан, г. Инчхон, Южная Корея
Читайте статьи:
30 Июня 2024
Новые технологии красоты


30 Июня 2024
Новые технологии красоты


30 Июня 2024
Новые технологии красоты


Все статьи из блога
Все статьи из блога









